Beste collega’s,
In deze klinische les gaan we het hebben over pijnlijke neuromen. Deze kunnen een complex en frustrerend probleem vormen voor patiënt en arts. Hoe herken je een neuroom en wat zijn de opties voor een behandeling?
Kernpunten
- Een neuroom is een goedaardige zenuwtumor die ontstaat door een woekering van beschadigde zenuwvezels en treedt nogal eens op na zenuwletsel of een amputatie.
- Neuromen kunnen hevige en moeilijk behandelbare neuropathische pijn veroorzaken in het verzorgingsgebied van een perifere sensibele of gemengde zenuw.
- De gouden standaard voor het aantonen van een symptomatisch perifeer neuroom is een echogeleide zenuwblokkade van de betrokken zenuw waarbij een vermindering van de pijn wordt gezien.
- Operatief ingrijpen door een plastisch chirurg met ervaring in zenuwchirurgie kan een effectieve en permanente behandeling zijn voor symptomatische neuromen.
- Er is een verschuiving gaande van conventionele chirurgische technieken zoals neurectomie en het begraven van de zenuwstomp in een spier naar nieuwe technieken, zoals doelgerichte spierreïnnervatie.
artikel
Een neuroom is een goedaardige zenuwtumor die ontstaat door een woekering van beschadigde zenuwvezels en die hevige pijn kan veroorzaken. Door onbekendheid met het beeld is er een aanzienlijke onderdiagnostiek. Ook is de rol van chirurgie in de behandeling van pijnlijke neuromen bij veel zorgverleners niet bekend. Chirurgie kan een belangrijke rol spelen bij de behandeling van de invaliderende en chronische pijn die wordt veroorzaakt door perifere neuromen, zoals blijkt uit de ziektegeschiedenissen van de volgende twee patiënten.
Patiënt A, een 47-jarige man, kwam op de polikliniek van de plastisch chirurg in verband met hevige pijn van de linker hand. Een jaar eerder had hij bij een bedrijfsongeval een traumatische amputatie van de duim halverwege de proximale falanx meegemaakt, waarna geen replantatie had plaatsgevonden. Op de polikliniek beschreef de patiënt hevige pijn en tintelingen in de stomp van de duim, waarvoor hij oxycodon 10 mg zo nodig gebruikte. Bij lichamelijk onderzoek ervoer de patiënt lichte aanraking van de stomp als zeer pijnlijk.
De plastisch chirurg behandelde de patiënt operatief wegens verdenking op een perifeer neuroom. De stomp werd ingekort en de radiale en ulnaire nn. digitales van de duim werden opgezocht. Bij beide zenuwen werd ter plaatse van de zenuwuiteinden een neuroom ontdekt en verwijderd. Vervolgens werd de m. adductor pollicis opgezocht in de thenar (duimmuis) en werden beide nn. digitales diep in deze spier begraven. Na de operatie begon de patiënt met fysiotherapie van de hand.
Hoewel de klachten van pijn in de eerste drie maanden na de operatie aanzienlijk afnamen, keerden zij daarna even hevig terug als voor de operatie. Op de 10-punts-visueel-analoge schaal (VAS) voor pijn was de pijnscore 10 in rust en bij bewegen van de stomp. Daarom werd twee jaar na de operatie een heroperatie uitgevoegd, waarbij een recidief van het neuroom werd gevonden in de ulnaire n. digitalis op de plaats waar de zenuw begraven was in de thenar. Dit recidiefneuroom werd verwijderd en beide nn. digitales werden doorgenomen en met een zenuwtransfer aangesloten op motorische zenuwtakjes naar spieren van de thenar. Zes maanden na deze operatie gaf de patiënt een significante vermindering van de pijn aan, met een VAS-pijnscore van 5 in rust en bij gebruik van de hand.
Patiënt B, een 46-jarige man, werd verwezen naar de plastisch chirurg in verband met aanhoudende pijn in de linker knie, na een gecompliceerd beloop van een tibiaplateaufractuur. De patiënt ervoer heftige pijn in rust en tijdens het belasten van het been, met een VAS-pijnscore van 8. Bij lichamelijk onderzoek was er hyperesthesie aan de mediale zijde van het onderbeen in het verzorgingsgebied van de n. saphenus. Bij een proefblokkade met lidocaïne verminderden de klachten significant.
Wij voerden een operatieve behandeling uit waarbij wij een perifeer neuroom van de n. saphenus vonden. Daarbij vond een zenuwtransfer plaats waarbij de n. saphenus in het distale bovenbeen werd doorgenomen en aangesloten op een van de motorische zenuwtakjes naar de m. vastus medialis. Twaalf maanden na de operatie gaf de patiënt geen pijnklachten meer aan, met een VAS pijnscore van 0 in rust en bij belasten. Ook de functie van het linker been en de kwaliteit van leven van de patiënt waren aanzienlijk verbeterd.
Beschouwing
In deze ziektegeschiedenissen hebben wij het beloop laten zien van twee patiënten met een perifeer neuroom die hiervoor operatief werden behandeld. In deze beschouwing gaan wij nader in op de herkenning van een symptomatisch neuroom en de chirurgische behandelopties.
Pathofysiologie van een perifeer neuroom
Als de continuïteit van een perifere zenuw onderbroken wordt, bijvoorbeeld door zenuwletsel of amputatie, groeien de axonen uit vanuit het proximale zenuwuiteinde en trachten zij de distale zenuwstomp te bereiken. Wanneer dit proces verkeerd of incompleet verloopt, bijvoorbeeld door overmatige fibrose, littekenvorming of de afwezigheid van een distale stomp – zoals na een amputatie – kan ongeorganiseerde en ongecontroleerde uitgroei van axonen leiden tot de vorming van een perifeer neuroom.1,2
Een neuroom is een goedaardige zenuwtumor die ontstaat door een woekering van zenuwvezels. Wanneer een neuroom zich aan het einde van de zenuwstomp van een doorgesneden zenuw bevindt, wordt dit een eindneuroom genoemd. Als de zenuw niet volledig was doorgesneden, kan een neuroom zich ook in de continuïteit van een zenuw bevinden. Dit heet een ‘neuroom in continuitatem’. Tussen de 3 en 10% van de patiënten ontwikkelen na zenuwletsel een pijnlijk neuroom.2 Na ledemaatsamputatie kan tot wel 48% van de patiënten pijnlijke neuromen ontwikkelen.3
Symptomen en diagnostiek
Neuromen kunnen neuropathische pijn veroorzaken die hardnekkig en invaliderend is, en die vaak een grote invloed heeft op de kwaliteit van leven. Op klinische gronden kan aan een neuroom gedacht worden bij pijn in het verzorgingsgebied van een perifere sensibele of gemengde zenuw of zenuwtak en bij persisterende pijn na een trauma of amputatie.2
Symptomen van neuromen zijn: spontane pijn; een verlaagde pijndrempel (hyperalgesie); koude-intolerantie; en pijn bij aanraking, druk of bewegen (allodynie).2 Ook kan de patiënt hierbij gevoelsstoornissen (hypesthesie of paresthesie) ervaren in het verzorgingsgebied van de betrokken perifere zenuw. Verder kunnen trofische veranderingen optreden (dat zijn veranderingen van huidskleur, haar- of nagelgroei) of veranderingen door een gebrek aan autonome innervatie, zoals temperatuurverandering van de huid.1
De symptomen van een perifeer neuroom kunnen lijken op die van het complex regionaal pijnsyndroom (CRPS) en zijn hiervan lastig te onderscheiden. Bij CRPS is de pijn echter regionaal en niet specifiek voor het verzorgingsgebied van een enkele zenuw of dermatoom; ook staan oedeem, atrofie, vasomotore of sudomotore afwijkingen van het ledemaat op de voorgrond.4
Bij patiënten die een amputatie hebben ondergaan, is het daarnaast van belang om onderscheid te maken tussen neuroompijn en fantoompijn. Fantoompijn is pijn die gevoeld wordt in het deel van het ledemaat dat er niet meer is, terwijl neuropathische pijn ten gevolge van een perifeer neuroom typisch in de stomp zelf gevoeld wordt, met het punctum maximum op de plaats van het desbetreffende zenuwuiteinde in de stomp.
Bij lichamelijk onderzoek is bij een neuroom de provocatietest van Tinel meestal positief.2 Dit houdt in dat wanneer er op de betreffende perifere zenuw getikt wordt, de patiënt tintelingen voelt in het verzorgingsgebied van diezelfde zenuw. De gouden standaard voor het aantonen van een symptomatisch neuroom is echter pijnreductie na een diagnostische, echogeleide zenuwblokkade van de betrokken zenuw met een lokaal anestheticum.2
Behandeling van een symptomatisch neuroom
Het doel van de behandeling van een perifeer neuroom is vermindering van de pijn en herstel van de functie van het ledemaat. De behandeling kan bestaan uit conservatieve of chirurgische therapie, maar is meestal een combinatie hiervan. Voor een optimale behandeling is het aan te raden om in overleg te gaan met een specialist pijngeneeskunde. Neuromen kunnen conservatief behandeld worden met pijnstilling, fysiotherapie, psychotherapie, neurorehabilitatie of neuromodulatie. Farmacologische behandeling bestaat vaak uit NSAID’s, antidepressiva, anti-epileptica, opiaten of een combinatie van deze middelen.1
Bij 50% van de patiënten heeft conservatieve therapie echter geen langdurig effect of geeft het een beperkte reductie van pijn; voor deze patiënten kan chirurgische behandeling een aanvullende therapie zijn.5 Onze ervaring is dat bij veel behandelaars niet bekend is dat chirurgie een rol kan spelen bij de behandeling van pijnlijke neuromen. Hiervoor kan de patiënt verwezen worden naar een plastisch chirurg met ervaring in zenuwchirurgie.
Operatieve behandeling
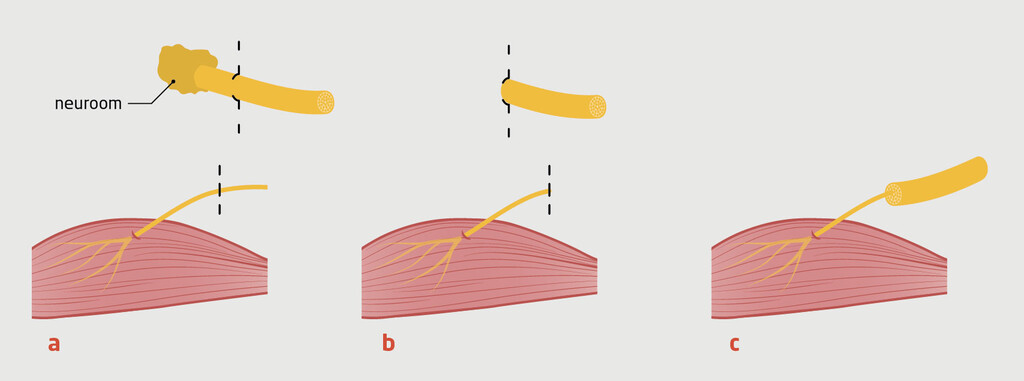
Voor de chirurgische behandeling van perifere neuromen zijn verscheidene technieken beschikbaar. De meest conventionele techniek is neurectomie, waarbij de zenuw wordt doorgenomen en het neuroom wordt verwijderd. Hiermee blijft echter het risico bestaan dat de uitgroeiende axonen vanuit de proximale stomp opnieuw zullen woekeren en een nieuw neuroom vormen. De ziektegeschiedenis van patiënt A laat zien dat een recidief van de neuroomvorming een belangrijk probleem is. Preventie van een recidief is een cruciaal onderdeel van de neuroomchirurgie. Om secundaire neuroomvorming te voorkomen zijn veel verschillende technieken bedacht waarbij de proximale zenuwstomp behandeld wordt. Zo kan de zenuwstomp begraven worden in omliggend spierweefsel, een vene of bot, of aangesloten worden op een nabijgelegen zenuw. Ook kan bijvoorbeeld een siliconen kapje op de zenuwstomp geplaatst worden, of de zenuwstomp kan chemisch behandeld worden.6
De meest gangbare chirurgische behandeling in Nederland is momenteel het begraven van de zenuwstomp in nabijgelegen spierweefsel, zoals beschreven bij patiënt A. Hierbij wordt het proximale zenuwuiteinde diep en spanningsvrij begraven in een lokale spier. Het idee is dat je een hiermee een beschermende omgeving creëert voor de zenuwstomp en de prikkelbaarheid vermindert, wat leidt tot minder secundaire neuroomvorming.3
Enkele klinische studies lieten zien dat het begraven van de zenuwstomp in spier bij sommige zenuwen, zoals de n. radialis superficialis in de onderarm, bij tot wel 90% van de patiënten effectieve en permanente pijnreductie bewerkstelligt.7 Een recente meta-analyse van alle literatuur liet echter zien dat het begraven in spier bij slechts 60-68% van de patiënten voldoende pijnreductie op de lange termijn geeft.8 De reden hiervoor is dat deze techniek, hoewel die bescherming biedt aan de zenuwstomp, niet aansluit bij de onderliggende pathofysiologie van een symptomatisch neuroom, zoals de ziektegeschiedenis van patiënt A laat zien. De zenuwstomp heeft na resectie van het neuroom namelijk geen functie meer en geen fysiologisch doel voor reïnnervatie, waardoor het zenuwuiteinde kan blijven woekeren. Regeneratie vanuit de zenuwstomp leidt daarom dikwijls tot een recidief van het neuroom en terugkeer van de klachten.8 Er is in de neuroomchirurgie daarom momenteel een verschuiving gaande naar zogeheten ‘actieve’ chirurgische behandelingen, zoals ‘targeted muscle reinnervation’.
Doelgerichte spierreïnnervatie
‘Targeted muscle reinnervation’ (TMR) is een nieuwe techniek binnen de perifere-zenuwchirurgie die wordt gebruikt bij de behandeling van pijnlijke neuromen. TMR is oorspronkelijk ontwikkeld om patiënten die een amputatie hebben ondergaan meer natuurlijke controle te geven over hun arm- of beenprothese. Bij deze operatie worden de zenuwuiteinden in de arm- of beenstomp zodanig verplaatst naar de overgebleven spieren dat daarmee verschillende functies van een prothese kunnen worden aangestuurd.
Hoewel het doel functionele verbetering was, bleek TMR ook zeer effectief voor het verminderen van neuropathische pijn en fantoompijn na een amputatie.9 Daarom werd TMR ook ingezet voor pijnreductie van symptomatische neuromen van oppervlakkige perifere zenuwen.
Bij TMR als behandeling voor een symptomatisch neuroom wordt na resectie van het neuroom de overgebleven zenuwstomp aangesloten op een van de motorische zenuwtakken van een nabijgelegen spier. De zenuwstomp kan dan via de donor-motorische zenuw naar de donorspier uitgroeien en deze innerveren (figuur). Doordat de spier geïnnerveerd wordt door meerdere motorische takken, gaat de functie van de spier niet verloren. De rationale is dat als de zenuwstomp gaat uitgroeien, de zenuwvezels een fysiologisch doel hebben om te innerveren. Dit geeft de doorgesneden zenuwvezels een ‘doel’ om naartoe te groeien en tot ‘rust’ te komen, waardoor zij geen pijnklachten meer geven.
De eerste vergelijkende studie naar TMR toonde aan dat deze techniek de pijn statistisch significant sterker reduceert dan conventionele neuroomchirurgie. In een gerandomiseerd, gecontroleerd onderzoek werden 28 patiënten met pijnlijke neuromen gerandomiseerd tussen behandeling met TMR en neurectomie. De patiënten die TMR ondergingen, hadden postoperatief statistisch significant minder neuropathische pijn, minder fantoompijn en een betere functie van het ledemaat.10 Volgens een recente meta-analyse werden bij volwassenen met pijnlijke neuromen met TMR goede postoperatieve resultaten (VAS pijnscore < 3) bereikt bij 82% van de patiënten, vergeleken met 60% na neurectomie.8 Toekomstig vergelijkend onderzoek moet echter nog aantonen of TMR betere resultaten geeft dan de operatieve standaardbehandeling, die bestaat uit het begraven van de zenuwstomp in een spier.
Beste collega's, pijnlijke neuromen zijn een veelvoorkomend probleem na zenuwletsel of bepaalde operaties, zoals een amputatie. Het is van belang te denken aan een perifeer neuroom bij pijn in het verzorgingsgebied van een perifere sensibele of gemengde zenuw of zenuwtak, met name na een trauma of amputatie. Adequate herkenning van pijnlijke neuromen is cruciaal om patiënten adequaat te kunnen behandelen voor hun invaliderende en chronische klachten.
Wij hebben met deze klinische les laten zien dat operatief ingrijpen een effectieve en permanente behandelingsoptie is voor symptomatische neuromen. De operatieve standaardbehandeling is het begraven van de zenuwstomp in nabijgelegen spier. Momenteel is er echter een verschuiving gaande naar nieuwe actieve technieken, zoals ‘targeted muscle reinnervation’ (doelgerichte spierreïnnervatie). Toekomstig onderzoek zal moeten uitwijzen of dit een effectievere oplossing is voor de invaliderende pijn door een perifeer neuroom dan het begraven van de zenuwstomp in spierweefsel.
Literatuur
-
Challoner T, Power D, Beale S, Nijran A. Pathogenesis, clinical evaluation and non-surgical management of symptomatic neuromas: A literature review. J Musculoskelet Surg Res. 2019;3:15-21.doi:10.4103/jmsr.jmsr_82_18.
-
Stokvis A, Coert JH. Operatieve behandeling van pijnlijke neuromen. Ned Tijdschr Geneeskd. 2011;155:A2592.
-
Penna A, Konstantatos AH, Cranwell W, Paul E, Bruscino-Raiola FR. Incidence and associations of painful neuroma in a contemporary cohort of lower-limb amputees. ANZ J Surg. 2018;88:491-6. doi:10.1111/ans.14293. Medline
-
Harden NR, Bruehl S, Perez RSGM, et al. Validation of proposed diagnostic criteria (the “Budapest Criteria”) for complex regional pain syndrome. Pain. 2010;150:268-74. doi:10.1016/j.pain.2010.04.030. Medline
-
Shaygan M, Böger A, Kröner-Herwig B. Predicting factors of outcome in multidisciplinary treatment of chronic neuropathic pain. J Pain Res. 2018;11:2433-43. doi:10.2147/JPR.S175817. Medline
-
Challoner T, Nijran A, Power D. The surgical management of traumatic neuromas. J Musculoskelet Surg Res. 2019;3:22-9. doi:10.4103/jmsr.jmsr_81_18.
-
Atherton DD, Fabre J, Anand P, Elliot D. Relocation of painful neuromas in Zone III of the hand and forearm. J Hand Surg Eur Vol. 2008;33:155-62. doi:10.1177/1753193408087107. Medline
-
Langeveld M, Hundepool CA, Duraku LS, Power DM, Rajaratnam V, Zuidam JM. Surgical treatment of peripheral nerve neuromas – a systematic review and meta-analysis. Plast Reconstr Surg. 2022;150:823e-4e. doi:10.1097/PRS.0000000000009545. Medline
-
Valerio IL, Dumanian GA, Jordan SW, et al. Preemptive treatment of phantom and residual limb pain with targeted muscle reinnervation at the time of major limb amputation. J Am Coll Surg. 2019;228:217-26. doi:10.1016/j.jamcollsurg.2018.12.015. Medline
-
Dumanian GA, Potter BK, Mioton LM, et al. Targeted muscle reinnervation treats neuroma and phantom pain in major limb amputees. Ann Surg. 2019;270:238-46. doi:10.1097/SLA.0000000000003088. Medline





targeted muscle reinnervation
Dank voor uw enthousiaste artikel over tmr behandeling bij symptomatische neuromen. Wij gebruiken deze mooie techniek ook al enkele jaren met wisselende resultaten.
Voor een artikel is het wel belangrijk om de juiste data te geven om te beginnen over de incidentie van symptomatische neuromen. U refereert naar een artikel van Penna uit 2018 (ref 3) waaruit blijkt dat de incidentie na beenamputaties laag is zo'n 4%. U beweert dat het meer dan 10 keer zo hoog is namelijk 48%. Misschien bedoelt u pijn in de amputatiestomp want dat komt wel vaak voor maar dat heeft meerdere oorzaken zoals huidproblemen door de koker met ulceratie of weke delen surplus dan wel myogene klachten of ischemie.
Verder haalt u het artikel van Dumanian aan uit 2018 (ref 10) waarin tmr wordt vergeleken met begraven van de zenuw in spierweefsel. Deze RCT heeft nogal wat methodologische beperkingen gekend waardoor slechts 15 patiënten in elke groep geanalyseerd konden worden terwijl er 200 inclusies nodig waren. Uw bewering dat er een statistisch significant verschil werd aangetoond klopt dus ook niet. De conclusie van deze kleine studie was dat de patiënten in de tmr groep een 'verbetering' lieten zien.
Uw conclusies zijn dan ook feitelijk onjuist en u zet de lezer op het verkeerde been.
reactie auteurs
Geachte dokter Frölke,
Hartelijk dank voor uw reactie op dit artikel.
Wat betreft uw eerste punt, refereerden wij Penna et al. (ref 3) die in hun artikel schrijven dat gevonden incidenties van symptomatische neuromen na amputatie oplopen tot 48%. Hoewel prevalenties en incidenties van symptomatische neuromen na amputatie wisselen in de literatuur, ondersteunen andere studies dat gevonden prevalenties hoog kunnen oplopen, zoals Faraji et al., die een prevalentie van 49% beschrijven (1). Door het beperkte aantal referenties dat is toegestaan, hebben wij enkel naar Penna et al. gerefereerd.
Om in te gaan op uw tweede punt, heeft uw reactie ons erop gewezen dat dit inderdaad geen correcte afspiegeling is van de uitkomst van het gerefereerde artikel. Onze intentie was om te refereren naar een meta-analyse (ref 8), waarin werd gevonden dat Targeted Muscle Reinnervation bij een significant groter percentage patiënten een goed postoperatief resultaat behaalt wat betreft pijn in vergelijking met conventionele neuroomchirurgie middels neurectomie (p = 0.0240). Een goed postoperatief resultaat werd in dit artikel gedefinieerd als een postoperatieve VAS/NRS score kleiner of gelijk aan 3 op een numerieke pijnschaal en complete resolutie van neuroompijn of milde postoperatieve pijn op een ordinale pijnschaal. In het vergelijkende artikel van Dumanian waar TMR wordt vergeleken met begraven van de zenuw in spierweefsel was enkel het verschil in vermindering van fantoompijnscore significant in een longitudinal mixed model analysis (p = 0.03) (ref 10). Voor stomppijn was er wel een verbetering, echter was dit verschil niet significant. Wij hebben een verzoek tot rectificatie gedaan op basis van uw commentaar.
Met vriendelijke groet,
Mirte Langeveld
1. Faraji E, Allami M, Feizollahi N, Karimi A, Yavari A, Soroush M, et al. Health concerns of veterans with high-level lower extremity amputations. Mil Med Res. 2018;5(1):36.