Rectificatie
Op dit artikel is de volgende verbetering gekomen:
In de tabel bij dit artikel staat in de kolom ‘definitie’ dat er sprake is van een verhoogde serumcreatinineconcentratie als het serumcreatinine > 132 mmol/l is. Dit moet zijn serumcreatinine > 132 μmol/l.
artikel
Dames en Heren,
Spontane colonperforaties zijn zeldzaam en komen hoofdzakelijk voor bij oudere patiënten met chronische obstipatie.1 In deze les beschrijven wij een patiënt bij wie de colonperforatie uiteindelijk toegeschreven werd aan een vorm van vasculitis: polyarteriitis nodosa (PAN).
Patiënt A, een 50-jarige West-Europese man, werd opgenomen op de afdeling Chirurgie wegens pijn in de epigastrische regio. Zijn voorgeschiedenis vermeldde een obstructief slaapapneusyndroom, een urachuscyste en een adenocarcinoom stadium T3N0M0 van het sigmoïd 6 jaar eerder waarvoor hij een sigmoïdresectie had ondergaan. De laatste controlecolonoscopie toonde geen aanwijzingen voor een recidief van de maligniteit.
Sinds 1 maand had patiënt intermitterend postprandiale pijn boven in de buik, misselijkheid en braken, verminderde eetlust, vermoeidheid en myalgieën. Ook was hij in 2 weken 5 kg afgevallen. Patiënt had geen koorts en zijn defecatiepatroon was niet afwijkend. Hij was 10 dagen eerder ontslagen na klinische observatie in verband met buikklachten. Aanvullend onderzoek, waaronder een CT-scan met intraveneus contrastmiddel in de veneuze fase, leverde geen aanknopingspunten voor de oorzaak van de klachten. Differentiaaldiagnostisch dachten wij aan een bindweefselstreng in de buik na voorgaande operaties of aan een symptomatische littekenbreuk. Patiënt herstelde spontaan en daarom werd toen afgezien van verdere diagnostiek.
Bij de huidige presentatie, 4 maanden na de laatste controlecolonoscopie, was de patiënt matig ziek en was de buik links boven licht drukpijnlijk. De bloeddruk bedroeg 142/82 mmHg en de temperatuur was 37,3 °C. Laboratoriumonderzoek toonde de volgende uitslagen (referentiewaarden tussen haakjes): leukocyten: 15,5 x 109/l (4,0-11,0); CRP: 132 mg/l (< 10); bezinking: 57 mm/1e uur (< 20); Hb: 7,8 mmol/l (8,5-11,0) en trombocyten: 482 x 109/l (150-400). De serumcreatinineconcentratie was 65 µmol/l (70-105). Uit urineonderzoek bleek een proteïnurie van 0,75 g/l (< 150 mg/24 h), deze werd niet nader onderzocht. De leverenzymwaarden waren niet afwijkend.
Een CT-scan van het abdomen met intraveneus contrastmiddel in de veneuze fase toonde het beeld van een wandverdikking in het colon transversum over een traject van 9 cm, omgeven door geïndureerd vet en een enkele gasbel buiten het colon. Beide bevindingen waren suggestief voor een gedekte perforatie. Ook was de wand van een paar dunnedarmlissen verdikt. Differentiaaldiagnostisch werd gedacht aan een corpus alienum, een geperforeerd divertikel of een gecompliceerd beloop van de ziekte van Crohn. Gezien het risico op verergering van de perforatie werd op dat moment afgezien van een colonoscopie.
Na behandeling met intraveneuze antibiotica herstelde patiënt en hij werd na 14 dagen ontslagen; het plan was om in een later stadium aanvullende diagnostiek te verrichten. Na 11 dagen kwam patiënt echter terug met dezelfde klachten. Bij palpatie was het abdomen soepel maar diffuus drukpijnlijk, met name rechts boven in de buik. Patiënt had geen verhoogde bloeddruk of koorts en er waren geen huidafwijkingen of tekenen van artritis. Het laboratoriumonderzoek toonde een leukocytose (20,8 x 109/l), een verhoogde CRP-waarde (306 mg/l) en een normocytaire anemie (Hb: 7,6 mmol/l). Het trombocytenaantal, de nierfunctie en de leverenzymwaarden waren niet afwijkend. Urineonderzoek werd niet verricht.
Een nieuwe CT-scan van het abdomen met intraveneus contrast in de veneuze fase liet een afname zien van het initiële infiltraat rondom het colon transversum, er was echter een nieuwe wandverdikking zichtbaar over een groot traject van het ileum en het caecum. Bij colonoscopie zagen wij een ulcererende, niet te passeren stenose in het colon transversum, zoals weergegeven in figuur 1a. Biopten van deze stenose toonden een deels fissurale ulceratie zonder granulomen.

Onder de werkdiagnose ‘ziekte van Crohn met gecompliceerd beloop’ werd patiënt opgenomen op de afdeling Maag-darm-leverziekten en begonnen wij behandeling met prednison 50 mg 1 dd per os. Hierop verminderden de klachten aanzienlijk en normaliseerden de ontstekingsparameters. Een controlecolonoscopie na 14 dagen liet afname van de ulceratie zien, maar de stenose was nog altijd niet te passeren (zie figuur 1b). Bij histopathologisch onderzoek waren de afwijkingen onveranderd en een aanvullende MRI-scan van de dunne darm liet geen afwijkingen zien. Door de uitblijvende reactie op prednison twijfelden wij aan de diagnose en werd de medicatie gestaakt. Na 12 dagen verrichtten wij een electieve colon-transversumresectie. Op dat moment was patiënt klachtenvrij en waren de ontstekingsparameters niet afwijkend.
Tijdens deze operatie ontstonden als gevolg van bestaande adhesies enkele dunne darmletsels die werden overhecht. Een naadlekkage compliceerde het postoperatieve beloop, waarvoor een relaparotomie werd uitgevoerd. Tijdens die ingreep constateerde de dienstdoende chirurg ischemische veranderingen en enige perforaties in het proximale jejunum en het ileum. Hij reseceerde de ischemische gedeelten en legde een eindstandig dunnedarmstoma aan. De eerder aangebrachte colonanastomose werd ontkoppeld waarna de distale lis blind werd gesloten en de proximale lis als externe mucusfistel werd gebruikt.
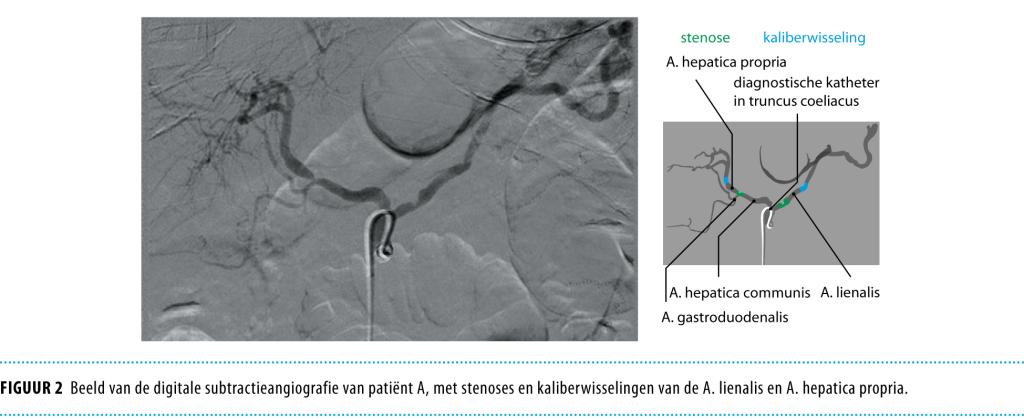
In verband met de uitgebreide ischemische veranderingen werd postoperatief een CT met intraveneus contrastmiddel in de arteriële fase (CT-angiografie) vervaardigd. Deze toonde een duidelijke stenose proximaal in de truncus coeliacus; de A. mesenterica superior en A. mesenterica inferior waren niet afwijkend. Hoewel de bloedvoorziening van het colon transversum wordt verzorgd door de A. colica media vanuit de A. mesenterica superior, besloten wij, gezien de ernst van de ischemische veranderingen, de stenose in de truncus coeliacus te dilateren en te overstenten.
Bij de digitale subtractieangiografie, vervaardigd ten tijde van het stenten, was het aspect van de A. mesenterica superior en de arteria colica media graciel en zagen wij kaliberwisselingen en lokale stenosen in de A. lienalis en de A. hepatica propria (figuur 2). Deze bevindingen leidden er toe dat de werkdiagnose, bijna 3 maanden na de initiële presentatie, gewijzigd werd naar ‘darmischemie als gevolg van vasculitis van de kleine en middelgrote arteriën’.
Hepatitis B en C, infectie met Yersinia en tuberculose werden uitgesloten met serologisch onderzoek en het cytomegalovirus door CMV-kleuring. Herhaaldelijke bloed-, feces- en urinekweken waren negatief, net als onderzoek naar de antinucleaire antistoffen (ANA) en antineutrofielencytoplasmatische antistoffen (ANCA).
Het resectiepreparaat van het colon transversum toonde een deels oppervlakkige en deels transmurale colitis met perforatie, dit leek te passen bij ischemie met secundaire bloedvatafwijkingen. In tweede instantie werd in een tweetal middelgrote arterietakken, die dieper in de subserosa lagen, echter een gemengdcellig ontstekingsinfiltraat in de vaatwand gevonden, bestaande uit neutrofiele en eosinofiele granulocyten, lymfocyten en histiocyten. In het lumen bevond zich een trombus. Dit beeld is zeer suggestief voor vasculitis (figuur 3).

Op grond van het klinische beloop, de chirurgische, radiologische en histopathologische bevindingen werd de diagnose ‘polyarteritis nodosa’ gesteld. Er werd gestart met prednison 1 mg/kg en cyclofosfamide 150 mg 1 dd. Hierop verdwenen de klachten van de patiënt en normaliseerden de ontstekingsparameters. Een controle-CT-angiografie van de mesenteriale vaten 6 maanden later toonde geen afwijkingen meer.
Wij vervingen de cyclofosfamide vervolgens door azathioprine en bouwden prednison af. Anderhalf jaar na de 1e presentatie heeft patiënt geen klachten meer en wordt een hersteloperatie gepland om het stoma op te heffen.
Beschouwing
Vasculitis van de mesenteriale vaten is meestal een manifestatie van een systeemziekte.2 Sporadisch wordt gelokaliseerde vasculitis in de literatuur als aparte entiteit beschreven. Op basis van de combinatie van de systemische symptomen, de aanvullende beeldvorming en uitslagen van histopathologisch onderzoek werd bij de beschreven patiënt de diagnose ‘PAN’ gesteld.
Gastro-intestinale manifestatie van polyarteriitis nodosa
PAN is een necrotiserende, focaal-segmentale vasculitis waarbij hoofdzakelijk de middelgrote en soms ook de kleine arteriën van verscheidene orgaansystemen zijn aangedaan.3 Gastro-intestinale betrokkenheid treedt op bij 14-65% van de patiënten met PAN en gaat gepaard met een hoge morbiditeit en mortaliteit.3
Symptomen bij de gastro-intestinale manifestatie van PAN ontstaan in weken tot maanden en gaan veelal gepaard met systemische klachten als hypertensie, myalgieën en huidafwijkingen. Patiënten presenteren zich vaak met misselijkheid, braken, anorexie, postprandiale buikpijn en soms met dunne bloederige defecatie als gevolg van ischemie.4 Complicaties zijn geassocieerd met een slechte prognose.3 Zo komt infarcering van de darm voor bij 1-2% van de patiënten, en treden perforaties op bij 5%.5
Epidemiologie
De gemiddelde leeftijd waarop PAN zich openbaart, varieert van 42-54 jaar. De jaarlijkse incidentie bedraagt 2,4 per 1.000.000 en de prevalentie onder Europeanen is 2 x hoger dan onder niet-Europeanen. PAN is bij 7% van de patiënten geassocieerd met een hepatitis B-virusinfectie.3 Er is tot op heden geen specifieke laboratoriumbepaling voor PAN en slechts bij 20% van de patiënten is de perinucleaire(p)-ANCA-test positief.6
Diagnostiek
De diagnose ‘PAN’ wordt gesteld op basis van het klinische beeld aangevuld met histologische en angiografische bevindingen. Beeldvormend onderzoek, zoals CT en endoscopie, toont vaak een aspecifiek colitisbeeld en met name endoscopische beelden kunnen gelijkenis vertonen met colitis in het kader van de ziekte van Crohn.7
Bij angiografie komen occlusies van de vaten het meest voor; de aanwezigheid van aneurysmata verhoogt de specificiteit van de diagnose ‘PAN’. In afwezigheid van aneurysmata zijn arteriële afwijkingen zoals kaliberwisselingen, stenosen en occlusies echter ook suggestief voor de diagnose.8 Mucosale biopten zijn voor het aantonen van een gastro-intestinale vasculitis weinig sensitief; ter bevestiging van de diagnose is meestal een transmuraal biopt of resectiepreparaat noodzakelijk.7 Klassiek in een dergelijk preparaat is het beeld van een gemengdcellige ontsteking van de middelgrote arteriën met monocyten, lymfocyten, polymorfonucleaire neutrofielen en necrotiserende angiitis. Hierbij is de lamina elastica interna ernstig aangedaan en is er sprake van fibrinoïde necrose van de tunica media.3
In 1990 werden door de American College of Rheumatology criteria opgesteld voor het classificeren van PAN; deze zijn weergegeven in de tabel.9 Hierin wordt gesteld dat een ziektebeeld als PAN geclassificeerd kan worden als voldaan wordt aan ten minste 3 van de 10 voorgestelde criteria. De door ons beschreven patiënt had gewichtsverlies, myalgieën, arteriografische afwijkingen en bijpassende histologische kenmerken waarmee hij voldeed aan de classificatiecriteria. Hoewel deze criteria als handvat kunnen dienen bij de diagnostiek van PAN, zijn zij niet bedoeld als diagnosticum bij de individuele patiënt bij wie gedacht wordt aan vasculitis.

Therapie
De behandeling van hepatitis B- en hepatitis C-negatieve PAN bestaat uit glucocorticoïden in combinatie met een krachtig immunosuppressivum, zoals cyclofosfamide. Hiermee wordt de recidiefincidentie gereduceerd.3 Een follow-up duur van minstens 5 jaar wordt geadviseerd om te controleren op een progressieve ziekte of een eventueel recidief.10 De 5-jaarsoverleving van patiënten met onbehandelde PAN bedraagt minder dan 15%,6 maar door adequate behandeling kan een 1-jaarsoverleving van 85% worden bereikt.3
Dames en Heren, deze ziektegeschiedenis toonde een patiënt met een gecompliceerd beloop van een mesenteriale vasculitis op basis van een polyarteriitis nodosa (PAN). Na diverse omzwervingen kon de uiteindelijke diagnose worden gesteld op basis van symptomen, aanvullende beeldvorming en histopathologisch onderzoek. De gastro-intestinale manifestatie van PAN gaat gepaard met een hoge morbiditeit en mortaliteit, deze kunnen sterk gereduceerd worden door adequate behandeling. Een belangrijke bijdrage in de diagnostiek bij gastro-intestinale PAN wordt geleverd door het aantonen van pathologische afwijkingen van de middelgrote en kleine arteriën door digitale subtractieangiografie, de huidige gouden standaard Mogelijk is er in de toekomst een rol weggelegd voor CT-angiografie wanneer deze de spatiële resolutie van een DSA minstens evenaart. De behandeling van hepatitis B- en hepatitis C-negatieve gastro-intestinale PAN bestaat uit hoge doses glucocorticoïden in combinatie met cyclofosfamide. De mortaliteit wordt hierdoor aanzienlijk gereduceerd, waardoor de 1-jaarsoverleving stijgt tot gemiddeld 85%.3
Leerpunten
Polyarteriitis nodosa is een systeemvasculitis; gastro-intestinale betrokkenheid gaat gepaard met hoge morbiditeit en mortaliteit.
Gastro-intestinale manifestatie van polyarteriitis nodosa geeft misselijkheid, braken, anorexie, postprandiale pijn en systemische symptomen als hypertensie en huidafwijkingen.
Digitale subtractieangiografie is de gouden standaard in de diagnostiek; bij polyarteriitis nodosa worden occlusieve afwijkingen en soms vrij specifieke aneurysmata in middelgrote en kleine arteriën gezien.
Behandeling met glucocorticoïden en immunosuppressiva reduceert de mortaliteit aanzienlijk; de 1-jaarsoverleving is na behandeling gemiddeld 85%.
Literatuur
Yang B, Ni HK. Diagnosis and treatment of spontaneous colonic perforation: analysis of 10 cases. World J Gastroenterol. 2008;14:4569-72 Medline. doi:10.3748/wjg.14.4569
Salvarani C, Calamia K, Crowson C, et al. Localized vasculitis of the gastrointestinal tract: a case series. Rheumatology. 2010;49:1326-35 Medline. doi:10.1093/rheumatology/keq093
Ebert EC, Hagspiel KD, Nagar M, Schlesinger N. Gastrointestinal involvement in Polyarteritis Nodosa. Clin Gastroenterol Hepatol. 2008;6:960-6 Medline. doi:10.1016/j.cgh.2008.04.004
Becker A, Mader R, Elias M, Lev A, Sayfan J. Duodenal necrosis as the presenting manifestation of polyarteritis nodosa. Clin Rheumatol. 2002;21:314-6 Medline. doi:10.1007/s100670200082
Cabal E, Holtz S. Polyarteritis as a cause of intestinal hemorrhage. Gastroenterology. 1971;61:99-105 Medline.
Ball G, Gay R. Vasculitis. In: Koopman WJ, Boulware DW, Heudebart G, eds. Koopman’s Textbook of arthritis and allied health conditions. 2nd ed. Philadelphia: Lippincott Williams & Wilkins; 2001:1655-95.
Pagnoux C, Mahr A, Cohen P, Guillevin L. Presentation and outcome of gastrointestinal involvement in systemic necrotizing vasculitides: analysis of 62 patients with polyarteritis nodosa, microscopic polyangiitis, Wegener granulomatosis, Churg-Strauss syndrome, or rheumatoid arthritis-associated vasculitis. Medicine. 2005;84:115-28 Medline. doi:10.1097/01.md.0000158825.87055.0b
Stanson AW, Friese J, Johnson C, et al. Polyarteritis Nodosa: Spectrum of Angiographic Findings. Radiographics. 2001;21:151-9 Medline.
Lightfoot RW Jr, Michel BA, Bloch DA, et al. The American College of Rheumatology 1990 criteria for the classification of polyarteritis nodosa. Arthritis Rheum. 1990;33:1088-93 Medline. doi:10.1002/art.1780330805
Gonzalez-Gay MA, Vazquez-Rodriguez TR, Miranda-Filloy JA, Pazos-Ferro A, Garcia-Rodeja E. Localized vasculitis of the gastrointestinal tract: a case report and literature review. Clin Exp Rheumatol. 2008;26:101-4 Medline.




Buikpijn door een microvasculaire oorzaak
Met grote interesse hebben wij het artikel gelezen van collegae Slegers et al. (NTVG 2012-11) over de gastro-intestinale manifestatie, de diagnostiek en de behandeling van polyarteritis nodosa (PAN). Terecht hebben de auteurs in hun differentiaal diagnostische analyse hepatitis B en C als bekende secundaire oorzaken van PAN uitgesloten. Dat PAN echter ook kan voorkomen secundair aan hematologische aandoeningen is minder bekend. Wij willen dit graag illustreren aan de hand van de volgende casus:
Recent zagen wij een 43-jarige man met een progressieve chronische myelomonocytaire leukemie (CMML, één van de vormen van het myelodysplastisch syndroom (MDS)) die zich presenteerde met spontane bloedingen in milt, longen en nieren. Angiografie toonde meerdere micro-aneurysmata in de middelgrote arteriën van de nieren. De diagnose PAN werd gesteld op basis van de diagnostische criteria van het American College of Rheumatology (ACR) 1990. Initiële behandeling met alleen corticosteroïden had onvoldoende effect; van gelijktijdige behandeling met cyclofosfamide werd afgezien in verband met een diepe trombocytopenie. Hierop werd besloten de onderliggende CMML te behandelen met chemotherapie (idarubicine / cytarabine). Hiermee kwam niet alleen de CMML in remissie maar bovendien trad volledig herstel van de PAN op.
Een recent gepubliceerd review van de literatuur over dit onderwerp suggereert inderdaad een verhoogde prevalentie van PAN en andere vormen van vasculitis secundair aan MDS, m.n. CMML.1 Daarnaast is er ook een associatie van PAN met hairy cel leukemie bekend.2 Bij patiënten met MDS en een secundaire PAN worden opvallend vaak nierbloedingen en gastrointestinale bloedingen beschreven. De prognose van patiënten met MDS lijkt slechter te zijn wanneer zij een PAN of andere systemische vasculitis ontwikkelen.1 Aangezien het adequaat behandelen van de onderliggende hematologische maligniteit de secundaire PAN kan genezen, zou dit deze ongunstige prognose kunnen verbeteren. Het tijdig vaststellen van de aanwezigheid van een primaire hematologische aandoening bij patiënten met PAN is hiervoor dan ook cruciaal. De indicatie voor behandeling dient, gezien de mogelijke toxiciteit hiervan, per individuele patiënt goed afgewogen te worden.
Drs. Rimke Oostvogels, UMC Utrecht, Afd. Hematologie, AIOS interne geneeskunde/ arts-onderzoeker hematologie
Dr. Eefke J. Petersen, UMC Utrecht, Afd. Hematologie, internist-hematoloog
Drs. Alferso C. Abrahams, UMC Utrecht, Afd. Nefrologie en Hypertensie, internist-nefroloog
Referenties