Casus 1
Patiënt A, een 80-jarige man, wordt gezien op de huisartsenpost in verband met een urineweginfectie en koorts (38,6°C). Hiervoor krijgt hij ciprofloxacine per os voorgeschreven. Zijn thuismedicatie omvat onder meer acenocoumarol. Kort na inname van de ciprofloxacine wordt hij onwel; hij is misselijk en moet braken. Daarop wordt hij opgenomen op de afdeling Interne Geneeskunde. Onder de werkdiagnose ‘gecompliceerde urineweginfectie’ wordt na afname van bloed- en urinekweken begonnen met intraveneuze toediening van ceftriaxon. Laboratoriumonderzoek toont een leukocytose, een lichte trombocytopenie, een verlengde PT en aPTT, en nierinsufficiëntie (tabel 1). Het urinesediment bevat een verhoogd aantal erytrocyten, leukocyten…
Artikelinformatie
Citeer dit artikel als
Antwoorden
Antwoord casus 1: 1b is juist
Patiënt A, een 80-jarige man, wordt vanwege een gecompliceerde urineweginfectie opgenomen op de afdeling Interne Geneeskunde. Hiervoor krijgt hij intraveneus ceftriaxon toegediend. Op de eerste ochtend na opname heeft hij een diepe trombocytopenie, zowel gemeten met de impedantiemethode als met de optische methode in de hemocytometrie-analyser. Een trombocytentelling in citraat sluit pseudotrombopenie (EDTA-trombopenie) uit (tabel 2).

In eerste instantie wordt de trombocytopenie beschouwd als een gevolg van diffuse intravasale stolling (DIS) bij de urosepsis. Verlengde stollingstijden gecombineerd met een verhoogde D-dimeerwaarde, een afbraakproduct van fibrine, ondersteunen deze diagnose. De verhoogde fibrinogeenconcentratie en het niet herstellen van het trombocytenaantal bij het verbeteren van de sepsis maakt de diagnose ‘DIS’ onwaarschijnlijk.
Er zijn geen aanwijzingen voor hemolyse; dit maakt de diagnose ‘trombotische trombocytopenische purpura’ onwaarschijnlijk, ondanks de aanwezigheid van fragmentocyten. De verlenging van de PT en aPTT worden verklaard door het gebruik van acenocoumarol. Fibrinogeen en D-dimeer zijn acutefase-eiwitten waarvan de concentratie verhoogd is door de urosepsis.
Opvallend is dat de trombocytopenie altijd het diepst is in de ochtend, vlak na toediening van de ceftriaxon (figuur a). Trombocytopenie is een weinig voorkomende bijwerking van ceftriaxon. Het onderliggende mechanisme wordt uitgelegd in de verdieping bij dit artikel. Omzetten van ceftriaxon naar ciprofloxacine leidt tot snel herstel van het trombocytenaantal. Hiermee is de patiënt in staat het ziekenhuis te verlaten. Bij deze patiënt is het gebruik van ceftriaxon en andere penicillineanalogen voortaan gecontra-indiceerd.

Antwoord casus 2: 2c is juist
Patiënt B, een 78-jarige man, krijgt een mitralisklepvervanging waarbij hij preoperatief ongefractioneerde heparine toegediend krijgt. De operatie verloopt ongecompliceerd; postoperatief begint hij met laag-moleculairgewicht-heparine naast acenocoumarol. Hij wordt 6 dagen na de operatie opgenomen op de afdeling Cardiologie voor revalidatie. Onverwacht ontwikkelt hij 9 dagen na de operatie een trombocytopenie.
Een pseudotrombocytopenie wordt uitgesloten met een trombocytentelling in citraatbloed. Omdat hij laag-moleculairgewicht-heparine gebruikt wordt op basis van klinische criteria – relatieve daling van het trombocytenaantal, tijdstip van de daling, aan- of afwezigheid trombose en mogelijke andere oorzaken – de waarschijnlijkheidsdiagnose ‘heparine-geïnduceerde trombocytopenie’ (HIT) vastgesteld. Immuungemedieerde trombocytopenie (ITP) is een diagnose bij uitsluiting en is hier dus minder waarschijnlijk.
De toediening van heparine wordt gestopt. Met een HIT-screeningstest wordt aangetoond dat patiënt B antistoffen heeft tegen heparine-plaatjesfactor4(PF4)-complex, die bij behandeling met heparine verantwoordelijk kunnen zijn voor trombocytopenie en trombo-embolische complicaties. Aanvullend onderzoek met een functionele test bevestigt vervolgens de diagnose ‘HIT’. De diepe daling van het trombocytenaantal na 5-10 dagen heparinegebruik past bij antistof-gemedieerde HIT type II. Dat houdt in dat patiënt B een absolute contra-indicatie heeft voor het gebruik van heparine.
Uitleg
Trombocyten (bloedplaatjes) zijn kleine, platte, kernloze celfragmenten – diameter circa 3 µm, dikte 1 µm – die door stimulatie met trombopoëtine uit megakaryocyten in het beenmerg worden gevormd.1 Er zijn ongeveer 150-450 x 109/l trombocyten in de bloedcirculatie aanwezig en de levensduur is 10-12 dagen. De trombocyten spelen een essentiële rol bij de hemostase. Verandering van functie leidt tot tal van ziekteprocessen, zoals bloedingen, trombose, embolie, arteriosclerose en ontstekingen. Trombocytopenie, gedefinieerd als een trombocytenaantal < 150 x 109/l, is een veelvoorkomende hematologische afwijking, vooral in de gehospitaliseerde populatie. We spreken van een ernstige trombocytopenie bij een trombocytenaantal van < 50 x 109/l. Een verhoogde bloedingsneiging treedt meestal pas op bij een trombocytenaantal van < 20 x 109/l. De diversiteit aan oorzaken kan de differentiaaldiagnose van trombocytopenie lastig maken.
Trombocytenbepaling
De trombocytentelling wordt tegenwoordig vrijwel uitsluitend gedaan in EDTA-volbloed op geavanceerde hematologie-analyzers. Hierbij wordt gebruik gemaakt van impedantie (volumemeting) en optische methoden (lichtverstrooiing).2 De impedantiemethode of ‘Coulter-principe’ berust op het gegeven dat bloedcellen elektrische stroom of radiogolven minder goed geleiden dan de oplossing waarin de cellen zich bevinden. Onder vacuüm wordt de bloedsuspensie door een nauwe opening (de apertuur) geleid en in een telbuis gebracht; dit heet ‘hydrodynamische focussing’. Als een bloedcel de telopening passeert, verandert de elektrische impedantie (weerstand) en varieert het signaal van de radiofrequentie tussen de elektrodes. Het aantal veranderingen is evenredig met het aantal getelde cellen en de mate van de impedantie is evenredig met het volume van de cel.2
De celtelling door optische lichtverstrooiing is meer recentelijk geïntroduceerd. Bij deze methode wordt een bloedmonster opgezogen, verdund in de gespecificeerde verdunning, gekleurd met een fluorescerende stof en gemeten in de detectiekamer van het betreffende meetkanaal. Omwille van nauwkeurigheid en reproduceerbaarheid wordt ook hier hydrodynamische focussing toegepast. Een laserstraal (golflengte: 633 nm) wordt gericht op de cellen die door het capillair gaan en 2 fotodetectoren vangen het licht op dat door de bloedcel in voorwaartse (‘forward scatter’) en zijwaartse richting (‘side scatter’) wordt verstrooid. De fluorescentie-intensiteit van elke cel wordt geanalyseerd; daaraan zijn trombocyten van erytrocyten en reticulocyten te onderscheiden. De mate van forward scatter geeft informatie over de grootte van de cel en de side scatter geeft informatie over de inhoud van de cel; het analyseapparaat zet dit uit in een scattergram.2
Diagnostiek van trombocytopenie
De diagnose ‘trombocytopenie’ wordt gesteld bij een trombocytengetal < 150 x 109/l. Bij een onverwachte trombocytopenie dient in eerste instantie een pseudotrombocytopenie te worden uitgesloten; dit fenomeen kan optreden bij een automatische telling in EDTA-volbloed (zie onder het kopje Valkuilen).1 Daarna wordt de etiologie van de trombocytopenie verder onderzocht.
Pathofysiologisch kan een trombocytopenie ontstaan door een aanmaakstoornis, toegenomen afbraak of verbruik. Ook kan er sprake zijn van een abnormale trombocytenverdeling.1 Tabel 3 geeft een overzicht van veelvoorkomende oorzaken van trombocytopenie bij volwassenen.

Een goede anamnese – inclusief familieanamnese – en lichamelijk onderzoek zijn de eerste stappen in het achterhalen van de oorzaak van de trombocytopenie. Laboratoriumonderzoek naar het volledige bloedbeeld, stolling en aanvullende diagnostiek geven verder richting (zie tabel 3).
In deze labquiz werken we de klinische evaluatie, het laboratoriumonderzoek en het mechanisme van geneesmiddel-geïnduceerde trombocytopenie (patiënt A) en heparine-geïnduceerde trombocytopenie (HIT, patiënt B) verder uit. De pathogenese, het klinische beloop en de behandeling van deze 2 vormen van trombocytopenie verschillen namelijk sterk van elkaar. Patiënt A loopt risico op ernstige bloedingen ten gevolge van de trombocytopenie, terwijl patiënt B met HIT juist risico loopt op trombo-embolische complicaties.
Medicijn-geïnduceerde trombocytopenie
Een groot aantal geneesmiddelen kan resulteren in trombocytopenie. Medicijn-geïnduceerde trombocytopenie is dan ook een belangrijke overweging bij trombocytopene patiënten. De etiologie wordt vaak niet meteen herkend en eerder toegeschreven aan andere complicaties zoals diffuus intravasale stolling (DIS) bij sepsis of immuungemedieerde trombocytopenie (ITP). Alhoewel een geneesmiddel-geïnduceerde trombocytopenie niet frequent voorkomt, kan deze aandoening resulteren in ernstige en zelfs fatale bloedingen.3-5 Daarom is het belangrijk dat het klinische beeld vroegtijdig herkend wordt en het betreffende geneesmiddel onmiddellijk wordt vervangen.
Het profylactisch toedienen van een trombocytenconcentraat kan geïndiceerd zijn bij een trombocytenaantal < 10 x 109/l, eventueel gecombineerd met intraveneuze immunoglobulinen (IVIG) of glucocorticoïden.6 Bij een bewezen geneesmiddel-geïnduceerde trombocytopenie bestaat er een absolute contra-indicatie voor toekomstig gebruik van het veroorzakende geneesmiddel. Voor een overzicht van medicamenten waarbij trombocytopenie voor kan komen verwijzen wij naar een onlinedatabase met meer dan 300 geneesmiddelen waarvan een causale relatie met trombocytopenie is vastgesteld (www.ouhsc.edu/platelets, klik op ‘DITP’).
Het onderliggend mechanisme van een geneesmiddel-geïnduceerde trombocytopenie is zeer divers. Bij de meeste patiënten wordt deze vorm van trombocytopenie veroorzaakt door antistoffen waarvan de ‘fragment antigen-binding’(Fab)-regio in de aanwezigheid van het geneesmiddel sterk bindt aan glycoproteïnen op het trombocytenmembraan.4,5 Dit betreft meestal glycoproteïne IIb-IIIa of Ib-V-IX. Medicijnen kunnen daarnaast ook een verandering in glycoproteïnen teweegbrengen die resulteert in de vorming van neo-epitopen, waartegen sommige individuen natuurlijk voorkomende antistoffen hebben of waartegen immunisatie kan optreden.
Bij het gebruik van ceftriaxon, dat bij patiënt A trombocytopenie veroorzaakte, kunnen geneesmiddel-afhankelijke haptenen worden gevormd die covalent binden aan trombocyten. Dit induceert een medicatie-specifieke immuunrespons tegen het medicatie-membraaneiwit-complex.4 Chemotherapeutica en immunosuppressiva daarentegen veroorzaken trombocytopenie door suppressie van de hematopoëse. Naast deze vormen kunnen sommige geneesmiddelen, waaronder procaïnamide en sulfonamiden, aanleiding geven tot de productie van auto-antistoffen.3,6
Tot slot zijn er monoklonale antistoffen die bestaan uit een humaan gedeelte en gedeelte afkomstig van de muis. Dit type middelen, waarvan abciximab een voorbeeld is, wordt steeds vaker gebruikt. Bij patiënten die deze middelen gebruiken kunnen van nature voorkomende antistoffen tegen het muisfragment leiden tot trombocytopenie.7
Diagnostiek van geneesmiddel-geïnduceerde trombocytopenie
Een geneesmiddel-geïnduceerde trombocytopenie is hoofdzakelijk een klinische diagnose. Tabel 4 geeft een overzicht van de klinische criteria die zijn ontwikkeld om het risico op een geneesmiddel-geïntroduceerde trombocytopenie in te schatten.8 De vorm van trombocytopenie is vaak ernstig en onverwacht; kenmerkend is de opeenvolging van episodes van trombocytopenie met tussendoor plotselinge verbetering.
Een tijdlijn met de uitslagen van opeenvolgende trombocytentellingen en momenten waarop medicatie werd toegediend kan bijdragen aan het stellen van de diagnose. Een antistof-geïnduceerde trombocytopenie ontstaat typisch 1-2 weken na het beginnen met een nieuw geneesmiddel of plotseling na een eerste dosering als een medicament in het verleden al eerder was toegediend. Als de patiënt van nature al bepaalde antistoffen heeft, kunnen sommige geneesmiddelen, waaronder antitrombotica als abciximab, tirofiban en eptifibatide, al direct na eerste toediening leiden tot ernstige trombocytopenie.4 Het trombocytenaantal herstelt meestal binnen 1-2 dagen na het staken van het verantwoordelijke geneesmiddel.
Naast het stellen van de diagnose aan de hand van klinische criteria is het raadzaam de etiologie te bevestigen door het aantonen van geneesmiddel-geïnduceerde anti-trombocytantilichamen. Deze antistoffen kunnen nog jaren na blootstelling aan het geneesmiddel aantoonbaar blijven. Vaak wordt deze bepaling uitgevoerd in een gespecialiseerd laboratorium waar men de beschikking heeft over positieve controles. Na incubatie van trombocyten of serum van de patiënt met het geneesmiddel wordt de aanwezigheid van geneesmiddel-specifieke antistoffen onderzocht met een trombocytenimmunofluorescentietest (PIFT) of met ‘monoclonal antibody immobilization of platelet antigens’ (MAIPA).9
Met de directe PIFT wordt onderzocht of er in vivo antistoffen aan de trombocyten gebonden zijn en zo ja, of deze behoren tot de IgG- of IgM-klasse. Een indirecte PIFT wordt uitgevoerd met serum van de patiënt om na te gaan of er in het plasma van de patiënt antistoffen circuleren die gericht zijn tegen trombocyten. De MAIPA-test toont aan of er anti-trombocytenantistoffen aanwezig zijn en tegen welke glycoproteïnen deze antistoffen gericht zijn. Met name voor het aantonen van autoantistoffen is deze techniek beduidend specifieker dan de directe en indirecte PIFT.
Het aantonen van antistoffen kan in de praktijk teleurstellend zijn. De assays zijn niet sensitief genoeg voor het detecteren van sommige antilichamen en de in-vitro-setting verschilt van condities in vivo. Vaak is het geneesmiddel zelf niet de oorzaak van de trombocytopenie, maar metabolieten ervan. In dat geval zijn de antistoffen in vitro niet goed aantoonbaar.4
Heparine-geïnduceerde trombocytopenie
Bij de meeste patiënten die ongefractioneerde heparine krijgen toegediend treedt onmiddellijk een daling op in het aantal trombocyten. Dit wordt veroorzaakt door een directe interactie tussen heparine en trombocyten, waarbij trombocyten aggregeren en het verbruik van trombocyten toeneemt. Deze vorm wordt HIT type I genoemd en is over het algemeen niet ernstig, omdat het trombocytenaantal – uitzonderingen daargelaten – niet onder de 100 x 109/l uitkomt.10
HIT type II treedt meestal op 5-10 dagen na het begin van heparinetoediening en komt voor bij circa 5% van de patiënten die behandeld worden met ongefractioneerde heparine.10,11 Bij patiënten die behandeld worden met laag-moleculairgewicht-heparine is het risico 10 maal lager.10,11 Kenmerkend is dat het trombocytenaantal daalt tot 40-80 x 109/l, dus minder sterk dan bij de geneesmiddel-geïnduceerde trombocytopenie, waar het trombocytenaantal vaak daalt tot < 20 x 109/l.12
HIT type II is het resultaat van de productie van antistoffen gericht tegen het heparine-plaatjesfactor4(PF4)-complex.10-12 Door deze antistofvorming ontstaan heparine-PF4-antistof complexen. De Fc-staarten van de antistoffen binden aan IgG-Fc-receptoren (FcRII) op trombocyten. Dit leidt tot trombocytenactivatie en uitstoot van PF4 uit de α-granula. Dit kan vervolgens resulteren in een toename van heparine-PF4-antistofcomplexen en leiden tot trombocytenaggregatie, endotheelbeschadiging en trombocytopenie. Niet de trombocytopenie, maar trombo-embolische complicaties als trombose, myocardinfarct en herseninfarct resulteren in klinische problemen. Deze doen zich voor bij circa 50% van de patiënten met HIT type II.10 HIT is dus een ernstige aandoening met een hoge mortaliteit (15%).
Bij een verdenking op HIT dient de heparine onmiddellijk te worden vervangen. Aangezien bij 40-70% van de patiënten kruisreactiviteit van de antistoffen met laag-moleculairgewicht-heparine optreedt, wordt vervanging van heparine door laag-moleculairgewicht-heparine afgeraden.10 Behandeling met een alternatief anticoagulans, zoals argatroban of danaparoïde, verdient de voorkeur.12 In de huidige CBO-richtlijn ‘Bloedtransfusie’ wordt het transfunderen van trombocyten afgeraden; alleen bij levensbedreigende bloedingen is het toedienen van een trombocytenconcentraat geïndiceerd.13 Vanwege boostering van antistoffen bij hernieuwd gebruik vormt bewezen HIT een absolute contra-indicatie voor het gebruik van heparine.
Diagnostiek van HIT
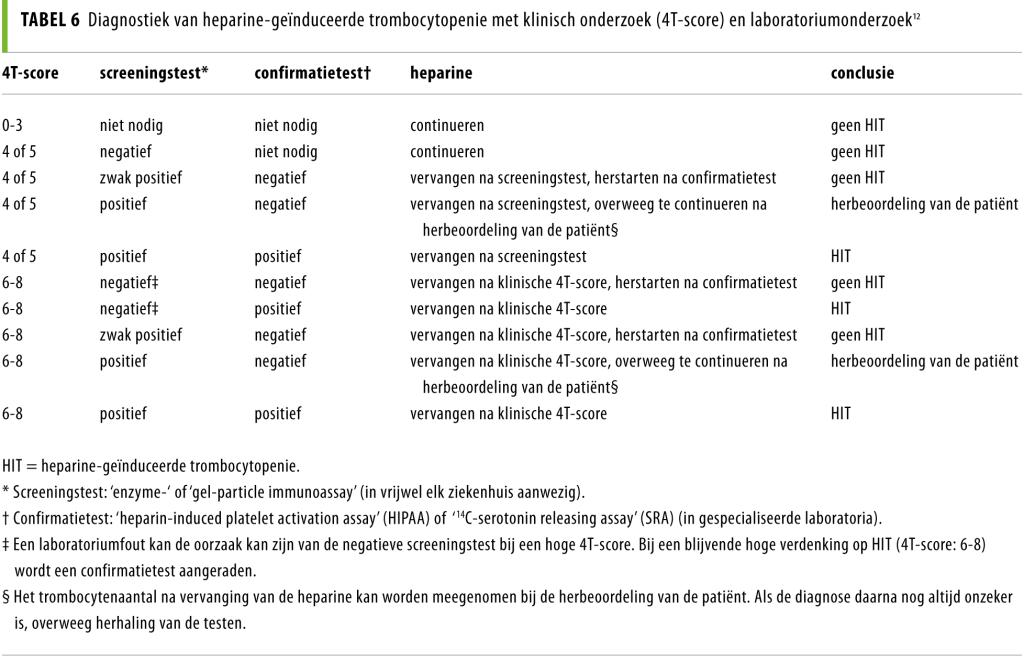
HIT is in eerste instantie een klinische diagnose. Om de waarschijnlijkheid van HIT vast te stellen wordt de ‘4T-score’ van Warkentin gebruikt. Hierbij wordt een score toegekend aan de mate van trombocytendaling, het tijdstip van de trombocytendaling, de aan- of afwezigheid van trombose en het uitsluiten van overige oorzaken (tabel 5).12 Bij een score 0-3 is de diagnose ‘HIT’ onwaarschijnlijk en hoeft geen verdere laboratoriumdiagnostiek te worden ingezet. Een intermediaire (4-5) of hoge score (6-8) geeft aanleiding tot laboratoriumdiagnostiek. Omdat er geen laboratoriumtest is die voldoende snelheid, sensitiviteit en specificiteit heeft, is het essentieel om bij een hoge waarschijnlijkheid de toediening van heparine te staken in afwachting van de uitslag van het laboratoriumonderzoek.10

Het laboratoriumonderzoek begint met een screeningstest om de aan- of afwezigheid van anti-heparine-PF4-antistoffen te bepalen. Dit kan bijvoorbeeld met een ‘particle gel immuno assay’ (PaGIA), die berust op agglutinatie van de antistoffen in het serum van de patiënt met polymeerdeeltjes die gecoat zijn met heparine-PF4-complex.14 Na centrifugatie door een gelfiltratiematrix zal er een agglutinatiecomplex zichtbaar zijn. De sensitiviteit van deze screeningstest is zeer hoog, maar de specificiteit is laag en daarom is de PaGIA alleen bruikbaar om de diagnose ‘HIT’ uit te sluiten.10,12
Ter bevestiging van een positieve testuitslag worden de ‘heparin-induced platelet activation assay’ (HIPAA) en de ‘14C-serotonin releasing assay’ (SRA) als gouden standaard gezien. Deze worden alleen in gespecialiseerde laboratoria uitgevoerd. De hoge specificiteit van deze testen reduceert het aantal fout-positieve uitslagen.10,12 Beide zijn functionele testen die bepalen hoe groot het vermogen van het serum van de patiënt is om trombocyten van gezonde donoren te activeren. De HIPAA meet de mate van trombocytenaggregatie en de SRA de inductie van de serotonine-secretiereactie door de antistoffen in het serum van de patiënt.15 Een positieve testuitslag bevestigt de diagnose ‘HIT’. Tabel 6 geeft een overzicht van de te nemen actie en interpretatie van de resultaten na het complete laboratoriumonderzoek.
Referentiewaarden, beslisgrenzen en testeigenschappen
De referentiewaarden voor de trombocytentelling zijn weergegeven in tabel 7.

Kosten
Het tarief voor de trombocytentelling, opgesteld door het College Tarieven Gezondheidszorg, bedraagt €1,50 per bepaling. Door de diversiteit aan oorzaken van trombocytopenie variëren de kosten van het overige laboratoriumonderzoek per patiënt.
Wanneer verschilt een uitslag significant van de vorige uitslag?
Bij een herhaalde laboratoriumbepaling is het van belang te weten wanneer de uitslagen voldoende van elkaar verschillen om te kunnen spreken van een daadwerkelijk klinisch relevant verschil. Dit zogenaamde kritische verschil wordt berekend door gebruik te maken van de biologische variatie binnen een individu (bron: www.westgard.com/biodatabase1.htm) en de analytische variatie. In tabel 7 staat de waarde van het kritische verschil van de trombocytentelling. Men mag de uitslag klinisch significant verschillend noemen van de voorgaande uitslag als de procentuele toe- of afname van een uitslag groter is dan het kritisch verschil.
Valkuilen
Bloed waarin het aantal trombocyten geteld moet worden, wordt opgevangen in een buis die een kleine hoeveelheid anticoagulans bevat. Inadequate menging van bloed en anticoagulans na de bloedafname kan leiden tot een schijnbaar verlaagd trombocytenaantal. Vertraagd contact tussen het bloed en het anticoagulans in de buis kan namelijk bloedstolling initiëren waardoor er stolsels ontstaan.
Verder kan het trombocytenaantal foutief verlaagd zijn bij de aanwezigheid van macrotrombocyten of trombocytenaggregaten. Dit laatste wordt EDTA-afhankelijke pseudotrombocytopenie genoemd. EDTA-afhankelijke pseudotrombocytopenie is een laboratoriumfenomeen met een incidentie van ongeveer 0,1% en is het gevolg van antistoffen in het plasma van de patiënt die reageren met antigenen op de eigen trombocyten die alleen tot expressie komen in aanwezigheid van EDTA (zogenoemde cryptantigenen).16 Dit leidt tot trombocytenaggregatie in vitro die zichtbaar is bij microscopisch onderzoek van een bloeduitstrijkje. Een trombocytentelling in citraatbloed of gehepariniseerd bloed geeft in dit geval een betrouwbare telling.
Een minder frequente oorzaak van pseudotrombocytopenie is satellitisme van trombocyten rond leukocyten. Hierbij hechten trombocyten zich in aanwezigheid van EDTA aan leukocyten.16 Dit fenomeen wordt gezien bij 1 op de 12000 trombocytentellingen.
Een foutief verhoogd trombocytenaantal kan optreden bij gebruik van de impedantiemethode als er fragmentocyten of micro-erytrocyten in het bloed aanwezigheid zijn. Deze kunnen voorkomen bij ernstige hemolyse.2 Bij trombocytengetallen < 100 x 109/l is de optische methode in de meeste gevallen nauwkeuriger dan de impedantiemethode, maar beiden hebben last van een hoge analytische variatie wanneer het trombocytenaantal zeer laag is.1




Reacties