Samenvatting
Het linker hartoor is de belangrijkste bron van emboli van cardiale oorsprong die leiden tot beroerte bij patiënten met atriumfibrilleren zonder hartkleplijden.
Orale antistolling is effectief gebleken ter preventie van beroerte bij atriumfibrilleren, maar wordt gecompliceerd door het inherente bloedingsrisico en de therapietrouw.
Mechanische sluiting van het linker hartoor lijkt een aantrekkelijk alternatief, vooral bij patiënten voor wie langdurige orale antistolling geen goede optie is. In de laatste 10 jaar zijn hiervoor meerdere percutane technieken beschikbaar gekomen, waaronder het WATCHMAN-device.
Gerandomiseerde studies met het WATCHMAN-device suggereren dat sluiting van het linker hartoor non-inferieur is aan orale antistolling als preventie van beroerte, met minder bloedingen. Prospectieve registratiestudies bij patiënten met een contra-indicatie voor orale antistolling bevestigen dat sluiting van het linker hartoor een aantrekkelijk alternatief is voor antistolling.
Lopende onderzoeken richten zich op vermindering van de complicaties bij de sluitingsprocedure, de laagste vorm van antistolling, vergelijking van bestaande technieken en vergelijking van linker-hartoorsluiting met de directe orale anticoagulantia.
Kernpunten
Een van de grote problemen van atriumfibrilleren is het verhoogde risico op een beroerte.
Het linker hartoor is de belangrijkste bron van trombi die leiden tot beroerte bij patiënten met atriumfibrilleren zonder hartkleplijden.
Orale antistolling verlaagt effectief het risico op beroerte bij patiënten met atriumfibrilleren, maar kan gepaard gaan met bloedingen, en is sterk afhankelijk van strenge INR-regulatie.
Sluiting van het linker hartoor met het paraplu-achtige WATCHMAN-device doet niet onder voor orale antistolling bij de preventie van beroerte, terwijl het aantal bloedingen lager is.
Mechanische sluiting van het linker hartoor kan met name een alternatief zijn voor patiënten bij wie langdurige orale antistolling geen goede optie is.
Lopend onderzoek moet meer duidelijkheid geven over de optimale techniek van hartoorsluiting en antistolling na de ingreep, en plaats van deze nieuwe techniek ten opzichte van de directe orale anticoagulantie.
artikel
Casus
Een 76-jarige vrouw heeft hypertensie, diabetes en atriumfibrilleren. In verband met het atriumfibrilleren gebruikt ze acenocoumarol. Daarnaast heeft ze recidiverende divertikelbloedingen. In verband hiermee vond 2 jaar geleden een partiële resectie van het sigmoïd plaats, maar inmiddels zijn er bloedingen op een nieuwe plek, nu proximaal van de anastomose. Door gebruik van de orale antistolling zijn de bloedingen hevig en was al meerder malen een bloedtransfusie noodzakelijk. Het stoppen van de antistolling zal haar risico op een CVA echter aanmerkelijk verhogen. Is er een alternatief voor de antistolling bij deze patiënte?
Atriumfibrilleren is de meest voorkomende hartritmestoornis; naar schatting 1 op de 4 mensen krijgt ooit in zijn of haar leven atriumfibrilleren.1 Een van de grote problemen van de stoornis is dat het risico op een beroerte met een factor 2-5 toeneemt. Het risico op beroerte kan worden geschat met de CHA2DS2-VASc-risicoscore. Bij een score van 2 of meer punten is er een dwingende indicatie voor beroertepreventie.1 Hoewel dit al decennialang gebeurt door de patiënt systemische antistolling voor te schrijven, is de laatste jaren sluiting van het linker hartoor (LAA) als lokale therapie sterk in opkomst.
In dit artikel geven we een overzicht van technieken om het LAA te sluiten, de resultaten van deze ingreep en de nieuwe ontwikkelingen op dit terrein. Voor dit overzicht hebben we gebruikgemaakt van de richtlijn van de European Society of Cardiology (ESC),1 de Leidraad Linker Hartoor Sluiting van de Nederlandse Vereniging voor Cardiologie (NVVC) en onderzoeken naar de impact van de HAS-BLED- en CHA2DS2-VASc-scores op bloedingen en CVA. Daarnaast hebben we alle literatuur over het WATCHMAN-device beoordeeld.
Tekortkomingen van antistolling
In de jaren 80 en 90 zijn er veel studies geweest die hebben aangetoond dat acetylsalicylzuur weinig effectief is, maar dat orale antistolling het risico op een beroerte bij atriumfibrilleren juist wel met 60-70% vermindert.1 Voor optimale preventie vereist de klassieke methode van antistolling met vitamine K-antagonisten (VKA) echter voortdurende controle van de INR-waarde. Ondanks die controle blijkt dat patiënten slechts 60-70% van de tijd in de therapeutische INR-range verkeren.
Bij te lage INR-waarden lopen patiënten nog steeds een verhoogd risico op een beroerte, bij te hoge waarden is juist het risico op bloedingen verhoogd. Hoewel de nieuwe directe orale anticoagulantia (NOAC) minstens gelijkwaardige preventie van beroerte bieden en de logistieke problemen rond de INR-controle wegnemen, stopt nog steeds 30% van de patiënten de therapie binnen 2 jaar door intolerantie of bloedingsproblemen; van de patiënten die VKA gebruiken stopt zelfs 50%.2 Daarnaast is er een groep patiënten die op voorhand al een dusdanig verhoogd bloedingsrisico hebben, dat zij niet eens ingesteld worden op antistolling.1
Afsluiting linker hartoor als alternatief
Reeds in de jaren 90 bleek dat bij patiënten met atriumfibrilleren zonder hartkleplijden het LAA de belangrijkste bron is van trombi die vastlopen in de hersenvaten.3 In de wereld van de hartchirurgie wordt mechanische afsluiting of verwijdering van het LAA al veel langer toegepast, als aanvulling bij hartklepoperaties en operaties ter correctie van het hartritme bij patiënten met atriumfibrilleren.1 Een overzichtsartikel uit 2009 toonde succesvolle sluiting bij slechts 59% van de patiënten; de sluiting was vooral succesvol wanneer het LAA werd geëxcideerd en de LAA-stomp werd afgehecht.4
Afgezien van het lage succespercentage is een LAA-sluiting tijdens een open-hartoperatie alleen acceptabel als bijkomende ingreep bij patiënten die om andere redenen al een hartoperatie ondergaan. Daarom is gezocht naar andere technieken waarvoor geen open-hartoperatie noodzakelijk is. De laatste 5 jaar is er ervaring opgedaan met de zogenoemde Atriclip, een klem die rond het LAA werd aangebracht. Hiervoor is echter nog steeds een thoracoscopische hartchirurgische ingreep nodig onder narcose, en er zijn nog geen gerandomiseerde studies naar de effectiviteit en veiligheid ten opzichte van antistolling.
In het afgelopen decennium is er anderzijds wel grote vooruitgang geboekt met alternatieve percutane methoden om het LAA te sluiten. Inmiddels staan hiervoor meerdere hulpmiddelen ter beschikking. De grootste categorie bestaat uit parapluutjes die het LAA van binnenuit afsluiten, terwijl een kleinere categorie gebruik maakt van een lassovormige hechting om het LAA van buitenaf af te snoeren (figuur 1).

De techniek van linker-hartoorsluiting
Atriclip
Sinds een aantal jaren wordt in een aantal hartchirurgische centra met de Atriclip gewerkt (zie figuur 1a). Deze klem wordt zo proximaal mogelijk op het LAA geplaatst. De epicardiale thoracoscopische benadering onder begeleiding van videobeelden vindt plaats terwijl de patiënt onder algehele narcose is. Via een kleine laterale incisie links tussen de ribben wordt toegang tot het hart verkregen. De linker long wordt daarbij tijdelijk minder geventileerd, zodat de klem rondom het LAA kan worden geplaatst. De initiële resultaten van deze techniek zijn goed als het gaat om volledige sluiting van het LAA.
Paraplu of plug
De meest gebruikte hulpmiddelen voor de sluiting van het LAA bestaan uit een paraplu of plug die percutaan via de lies wordt ingebracht (zie figuur 1b). Daarbij wordt meestal gebruikgemaakt van röntgendoorlichting en 3D-slokdarmechocardiografie. Vanwege de grote diversiteit in vorm, grootte, en oriëntatie van het LAA wordt vaak ook tevoren al 3D-slokdarmechocardiografie of CT verricht. Dit kan helpen bij de keuze van het soort device en de juiste maatvoering voor optimale sluiting.
De parapluutjes en pluggen zijn allemaal gemaakt van een nitinolframe. Nitinol is een geheugenmetaal; dit betekent dat het parapluutje geheel kan worden opgevouwen in een implantatiekatheter en bij ontplooiing weer de oorspronkelijke vorm zal aannemen. Het parapluutje moet altijd wat groter zijn dan het hartoor zelf, zodat het goed wordt vastgeklemd. Rond het device zitten kleine weerhaakjes die zich vastzetten in het weefsel, waardoor het niet meer kan migreren.
Het device wordt opgevoerd via de V. femoralis en, na transseptale punctie naar de linkerboezem, ontvouwen in het LAA. De procedure kan zowel worden gedaan onder lokale pijnstilling in de lies met lidocaïne en lichte sedatie met benzodiazepine intraveneus, als onder algehele narcose. Als na ontplooiing van het device aan alle criteria van positie, afsluiting, stabiliteit, en verankering is voldaan, wordt de katheter teruggetrokken uit het hart en wordt de insteekopening in de lies afgesloten met een tijdelijke hechting of drukverband.
In de eerste maanden na sluiting van het LAA moet het device langzaam bedekt raken met lichaamseigen weefsel en ingroeien in het LAA. In die periode wordt voor bijna alle devices meestal plaatsjesaggregatieremming met acetylsalicylzuur of clopidogrel voorgeschreven, of tijdelijk VKA of NOAC-therapie voortgezet. Ondanks deze maatregelen wordt bij 3-4% van alle patiënten een trombus op het device gezien, overigens zonder dat dit leidt tot beroerte.
Als na enige maanden bij slokdarm-echo controle de LAA-sluiting geslaagd blijkt (dat wil zeggen: geen bloedstroom naar het LAA of een opening < 5 mm), kan alle antistollingsmedicatie meestal na 6-12 maanden worden gestaakt.
Epicardiale lasso
De epicardiale lasso-devices lijken in opzet meer op de chirurgische methode en gebeuren meestal ook onder diepe sedatie of narcose. Het hartzakje wordt bereikt via een punctie onder het borstbeen. Om het LAA in positie te houden voor de lasso wordt hetzij aan de LAA-punt getrokken, of via de lies een endocardiale katheter in het LAA gebracht die met een magneet koppelt aan de epicardiale lasso (zie figuur 1c). Daarna wordt de lasso van buitenaf om het LAA heen aangebracht en aangetrokken om het af te snoeren.
Alle epicardiale technieken resulteren – mits compleet – in een directe afsluiting en uiteindelijk verschrompeling van het LAA, maar zijn meer bewerkelijk en invasief. Over het al dan niet gebruiken van antistolling na deze ingrepen is geen consensusbeleid.
Uitkomsten en indicaties
Hoewel er inmiddels meerdere percutane devices voor LAA-sluiting op de markt zijn verschenen, bestaat de literatuur voornamelijk nog uit kleinere monocentrische en multicentrische registratiestudies waarin de eerste ervaringen en uitkomsten van de ingreep worden beschreven. Gezien de veelheid aan devices is het ondoenlijk om hiervan een uitgebreide opsomming te geven. Dit geldt ook voor de thoracoscopische Atriclip, die al enkele jaren op de markt is; er zijn nog geen langetermijnstudies naar het effect van deze ingreep als monotherapie op de preventie van beroerte. Alleen voor het percutane WATCHMAN-device zijn er resultaten gepubliceerd van gerandomiseerde klinische studies waarbij LAA-sluiting direct is vergeleken met VKA-therapie.
PROTECT-AF-studie
In de PROTECT-AF-studie – waar 707 patiënten aan deelnamen, met een CHA2DS2-VASc-score van gemiddeld 3,4 – traden procedurele complicaties op bij 8,7% van de 473 patiënten bij wie het LAA werd gesloten, voornamelijk door bloeding in de lies en het hartzakje.5 De 4-jaarsanalyse toonde echter dat de langetermijnuitkomsten voor deze 473 patiënten veel gunstiger waren dan voor de 244 patiënten die waren behandeld met VKA. De gecombineerde uitkomstmaat voor beroerte, embolie en sterfte was veel lager in de WATCHMAN-groep (8,4 vs. 13,9 events per 100 patiëntjaren; hazardratio (HR): 0,6; p = 0,005), en dat gold ook voor de totale mortaliteit (3,2 vs. 4,8 per 100 patiëntjaren; HR: 0,68; p = 0,04). Bovendien kwamen de aantallen complicaties in de 2 groepen in de loop van de 4 jaren dicht bij elkaar te liggen, vooral door bloedingen bij patiënten die voortdurend waren blootgesteld aan VKA-therapie (3,6 vs. 3,1 per 100 patiëntjaren; HR: 1,21; p = 0,41).6
PREVAIL-studie
Omdat de Amerikaanse Food and Drug Administration (FDA) voor toelating in de VS aanvullende resultaten eiste, werd de PROTECT-AF-trial voortgezet met de PREVAIL-studie.7 Van de 407 patiënten werden er 100 meegenomen uit PROTECT-AF, en de CHA2DS2-VASc-score voor inclusie was hoger (gemiddeld 4,4). Het aantal procedurele complicaties bij LAA-sluiting was door toegenomen ervaring nog maar 4,2%, ruim de helft lager dan in PROTECT-AF. De primaire uitkomstmaat ‘sterfte, beroerte en embolie’ was na 5 jaar weliswaar vergelijkbaar in beide groepen, maar in dit opzicht was LAA-sluiting statistisch gezien inferieur (0,066 vs. 0,051; RR: 1.33; probability: 88,4%).7 De afzonderlijke uitkomstmaat ‘ischemische beroerte’ was numeriek hoger dan bij patiënten die behandeld werden met VKA, maar bereikte wel non-inferioriteit in vergelijking met VKA (0,0255 vs. 0,0135; RR: 2,2; probability: 97,5%).6
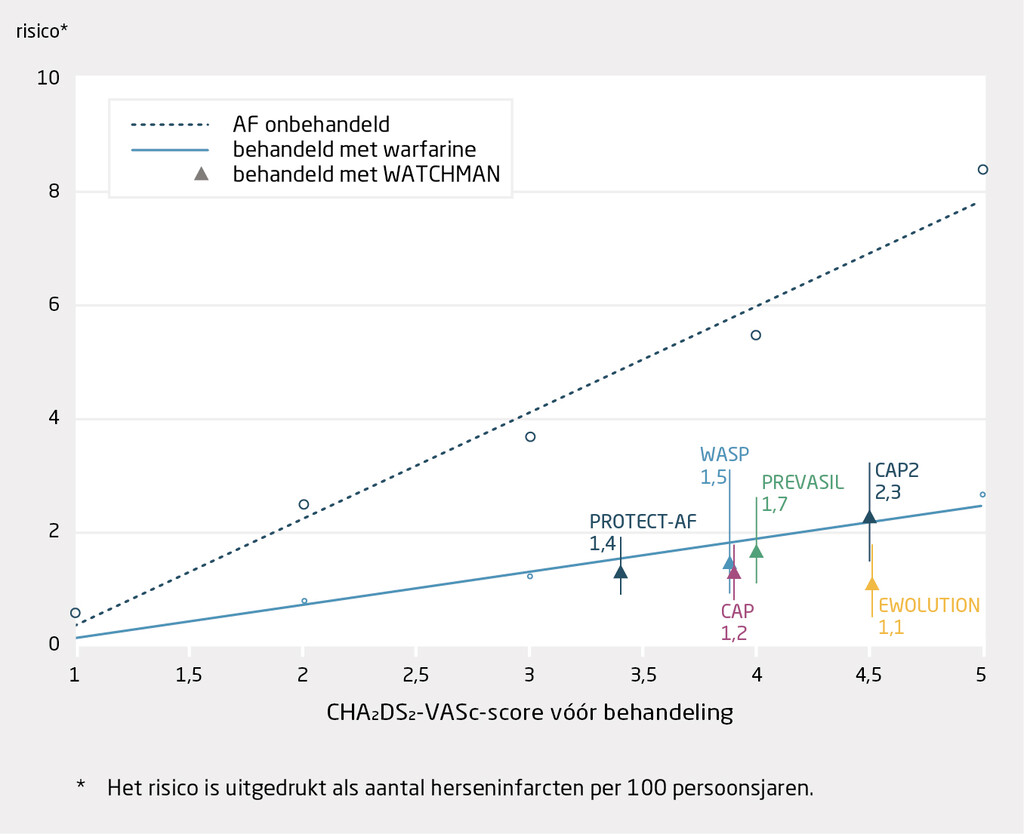
Inmiddels blijkt uit de 5-jaarsresultaten van de beide studies tezamen dat LAA-sluiting met WATCHMAN even effectief is als VKA voor preventie van sterfte, beroerte, en embolie (2,8% vs. 3,4%; HR: 0,82; p = 0,27).8 Daarnaast ging LAA-sluiting gepaard met een significant lager risico op bloedingen – in het bijzonder hersenbloedingen –, invaliderende beroerte, en mortaliteit (figuur 2).8

Wie komt voor LAA-sluiting in aanmerking?
De uitkomsten van de gerandomiseerde PROTECT AF en PREVAIL-studie suggereren dat LAA-sluiting een goed alternatief voor antistolling kan zijn voor patiënten met atriumfibrilleren die een verhoogd risico op beroerte hebben en bij wie het atriumfibrilleren niet aan hartkleplijden gerelateerd is. Afgezien van een aantal praktische redenen zijn er echter ook inhoudelijke overwegingen om in de praktijk niet snel naar dit alternatief te grijpen.
Allereerst kan iedere arts zonder enig probleem antistollingstherapie voorschrijven, terwijl voor LAA-sluiting een ingreep door een hartspecialist noodzakelijk is. Daarnaast is de prevalentie van atriumfibrilleren in de bevolking relatief hoog, en is er op de korte termijn geen capaciteit om deze ingreep op grote schaal toe te passen. Bovendien betreffen de gegevens uit RCT’s – PROTECT-AF en PREVAIL – vooralsnog alleen de toepassing van het WATCHMAN-device.5,7-8 Deze interventiestudies zijn bescheiden van omvang vergeleken met de grote NOAC-studies, waaraan 70.000 patiënten hebben deelgenomen. In de ESC-richtlijn uit 2016 voor de behandeling van atriumfibrilleren heeft LAA-sluiting dan ook vooralsnog een klasse 2b-indicatie gekregen, en bovendien alleen voor patiënten met een zeer zwaarwegende contra-indicatie voor antistolling.1
ASAP- en EWOLUTION-studie
De beperking van de indicatie tot patiënten met een zeer zwaarwegende contra-indicatie voor antistolling is op zichzelf wat merkwaardig te noemen, aangezien er in de literatuur over hartoorsluiting vóór 2016 nauwelijks resultaten voorhanden waren van studies bij deze specifieke patiëntengroep. Alleen de prospectieve ASAP-registratiestudie bij 150 patiënten met een contra-indicatie voor VKA liet zien dat het optreden van beroerte 72% lager lag dan voorspeld na LAA-sluiting met de WATCHMAN, zonder gebruik van antistolling.9
Recent zijn daar de resultaten van de EWOLUTION-studie bijgekomen, een grote prospectieve multicentrische registratiestudie met meer dan 1000 patiënten uit Europa van wie er meer dan 700 een contra-indicatie hadden voor antistolling.10,11 In de EWOLUTION-studie bleek het aantal procedurele complicaties inmiddels nog maar een derde van het aantal in de PROTECT-AF-studie. Het aantal beroertes was met 1,1% zo’n 85% lager dan verwacht (7,2%) zonder gebruik van VKA,12 terwijl het aantal bloedingen zo’n 50% lager zou zijn dan verwacht (2,3% in plaats van 5,0%) als deze patiënten toch VKA zouden gebruiken.13
Als we de resultaten van alle grote onderzoeken naar LAA-sluiting met het WATCHMAN-device bij elkaar zetten, laat het totaalbeeld zien dat LAA-sluiting niet lijkt onder te doen voor VKA en veel beter is dan helemaal geen antistolling (figuur 3).8 Dit biedt goede hoop voor de populatie met een dwingende contra-indicatie voor antistolling.
Kennishiaten en toekomst
Op basis van de studies die sinds 2009 zijn verschenen is LAA-sluiting in landen als de Verenigde Staten en Australië en in Europese landen – waaronder Duitsland, Polen, Zwitserland, Griekenland, Italië, Frankrijk, en België – een geaccepteerde therapie geworden om beroerte bij patiënten met atriumfibrilleren te voorkómen. Toch hebben de resultaten van de PROTECT-AF- en PREVAIL-studies nog niet alle behandelaars – ook niet alle cardiologen – ervan overtuigd dat LAA-sluiting in de richtlijnen een hogere classificatie moet krijgen.
De uitkomsten van de registratiestudies, waarin resultaten bij patiënten met een contra-indicatie voor VKA werden vergeleken met historische data, hebben niet dezelfde wetenschappelijke overtuigingskracht als een gerandomiseerde studie. Aan randomisatie naar antistolling kleeft echter een ethisch dilemma wanneer het gaat om patiënten met een contra-indicatie voor VKA, en ook praktisch is zo’n randomisatie niet haalbaar vanwege de vrees bij arts en patiënt voor de bloedingen die kunnen optreden.
Vergelijking met NOAC’s
Inmiddels hebben de NOAC’s in de ESC-richtlijn voor atriumfibrilleren de plaats van VKA overgenomen als voorkeursbehandeling voor de preventie van beroerte, omdat NOAC’s mogelijk effectiever zijn bij de preventie van beroerte, terwijl zij een lagere risico op hersenbloedingen geven. Bij menigeen is er behoefte aan een gerandomiseerde studie waarbij LAA-sluiting direct wordt vergeleken met NOAC-therapie.
Hoewel de nog lopende PRAGUE-17-studie aan die behoefte zou kunnen voldoen,14 lijkt deze op voorhand niet robuust genoeg van opzet om sluitend bewijs over de plaats van LAA-sluiting te leveren. De OPTION-studie, waarin patiënten gerandomiseerd zullen worden tussen WATCHMAN en NOAC na ablatietherapie voor atriumfibrilleren, is nog in een voorbereidende fase. Voorlopig zijn er op korte termijn geen uitkomsten op dit gebied te verwachten.
Plaatjesaggregatieremming
Een andere zorg is het feit dat patiënten na LAA-sluiting vaak voor langere tijd acetylsalicylzuur blijven gebruiken, zelfs enige tijd in combinatie met clopidogrel, uit angst voor trombusvorming op het LAA-device en het risico op secundaire beroerte. Door deze dubbele bloedplaatjesaggregatieremming kan de daadwerkelijke effectiviteit van LAA-sluiting overschat worden. Bovendien kan het risico op bloedingen toenemen tot hetzelfde niveau als bij gebruik van een NOAC. Of dergelijke intensieve plaatjesremming echt nodig is bij LAA-sluiting is eigenlijk nooit onderzocht.
Inmiddels is de ASAP TOO-studie gestart, waarin patiënten met een contra-indicatie voor VKA worden gerandomiseerd tussen ofwel alleen acetylsalicylzuur, ofwel LAA-sluiting met het WATCHMAN-device, waarbij de periode van plaatjesaggregatieremming na de ingreep drastisch is ingekort.15
Nieuwe devices
Naast het WATCHMAN-device voor LAA-sluiting (zie figuur 1b) zijn er inmiddels nog meer devices waarbij met sommige daarvan reeds goede resultaten behaald worden. Inmiddels lopen er vergelijkende studies waarin de AMULET- en de WAVECREST-parapluutjes worden vergeleken met het WATCHMAN-device, gericht op toelating op de Amerikaanse markt door de FDA. Deze studies zullen inzicht bieden in de vraag of er verschillen zijn tussen de devices voor LAA-sluiting, die elk hun eigen constructie en antistollingsbeleid in de periode na de ingreep hebben. Ook externe sluitingsmethodes zoals LARIAT (zie figuur 1c) en thoracoscopische chirurgische methodes zoals de Atriclip (zie figuur 1a) zijn in opkomst, met name als onderdeel van curatieve – chirurgische – ingrepen voor de behandeling van hartritmestoornissen.
In Nederland wordt LAA-sluiting sinds 2009 op zeer kleine schaal en met name in studieverband toegepast in een beperkt aantal gespecialiseerde ziekenhuizen. De ingreep is – in tegenstelling tot in andere West-Europese landen –niet opgenomen in het pakket voor verzekerde zorg in Nederland. De Nederlandse Vereniging voor Cardiologie volgt in haar Leidraad Linker Hartoor Sluiting uit 2017 dezelfde indicatiegebieden als de ESC, met strenge adviezen voor de centra die deze therapie aanbieden.16
Literatuur
Kirchhof P, Benussi S, Kotecha D, et al; ESC Scientific Document Group. 2016 ESC Guidelines for the management of atrial fibrillation developed in collaboration with EACTS. Eur Heart J. 2016;37:2893-962. Medlinedoi:10.1093/eurheartj/ehw210
Martinez C, Katholing A, Wallenhorst C, Freedman SB. Therapy persistence in newly diagnosed non-valvular atrial fibrillation treated with warfarin or NOAC. Thromb Haemost. 2016;115:31-9. Medlinedoi:10.1160/TH15-04-0350
Blackshear JL, Odell JA. Appendage obliteration to reduce stroke in cardiac surgical patients with atrial fibrillation. Ann Thorac Surg. 1996;61:755-9. Medlinedoi:10.1016/0003-4975(95)00887-X
Kanderian AS, Gillinov AM, Pettersson GB, Blackstone E, Klein AL. Success of surgical left atrial appendage closure: assessment by transesophageal echocardiography. J Am Coll Cardiol. 2008;52:924-9. Medlinedoi:10.1016/j.jacc.2008.03.067
Reddy VY, Sievert H, Halperin J, et al; PROTECT AF Steering Committee and Investigators. Percutaneous left atrial appendage closure vs warfarin for atrial fibrillation: a randomized clinical trial. JAMA. 2014;312:1988-98. Medlinedoi:10.1001/jama.2014.15192
Price MJ, Reddy VY, Valderrábano M, et al. bleeding outcomes after left atrial appendage closure compared with long-term warfarin: a pooled, patient-level analysis of the WATCHMAN randomized trial experience. JACC Cardiovasc Interv. 2015;8:1925-32. Medlinedoi:10.1016/j.jcin.2015.08.035
Holmes DR Jr, Kar S, Price MJ, et al. Prospective randomized evaluation of the Watchman Left Atrial Appendage Closure device in patients with atrial fibrillation versus long-term warfarin therapy: the PREVAIL trial. J Am Coll Cardiol. 2014;64:1-12. Medlinedoi:10.1016/j.jacc.2014.04.029
Reddy V, Doshi S, Kar S, Gibson D, Price MJ, Huber K, et al. PREVAIL and PROTECT AF Investigators. 5-Year outcomes after left atrial appendage closure: from the PREVAIL and PROTECT AF trials. J Am Coll Cardiol. 2017;70:2964-75. doi:10.1016/j.jacc.2017.10.021Medline
Reddy VY, Möbius-Winkler S, Miller MA, et al. Left atrial appendage closure with the Watchman device in patients with a contraindication for oral anticoagulation: the ASAP study (ASA Plavix Feasibility Study With Watchman Left Atrial Appendage Closure Technology). J Am Coll Cardiol. 2013;61:2551-6. Medlinedoi:10.1016/j.jacc.2013.03.035
Boersma LV, Schmidt B, Betts TR, et al; EWOLUTION investigators. Implant success and safety of left atrial appendage closure with the WATCHMAN device: peri-procedural outcomes from the EWOLUTION registry. Eur Heart J. 2016;37:2465-74. Medlinedoi:10.1093/eurheartj/ehv730
Boersma LV, Ince H, Kische S, et al; EWOLUTION Investigators. Efficacy and safety of left atrial appendage closure with WATCHMAN in patients with or without contraindication to oral anticoagulation: 1-Year follow-up outcome data of the EWOLUTION trial. Heart Rhythm. 2017;14:1302-8. Medlinedoi:10.1016/j.hrthm.2017.05.038
Friberg L, Rosenqvist M, Lip GY. Evaluation of risk stratification schemes for ischaemic stroke and bleeding in 182 678 patients with atrial fibrillation: the Swedish Atrial Fibrillation cohort study. Eur Heart J. 2012;33:1500-10. Medlinedoi:10.1093/eurheartj/ehr488
Lip GYH, Frison L, Halperin JL, Lane DA. Comparative validation of a novel risk score for predicting bleeding risk in anticoagulated patients with atrial fibrillation: the HAS-BLED (Hypertension, Abnormal Renal/Liver Function, Stroke, Bleeding History or Predisposition, Labile INR, Elderly, Drugs/Alcohol Concomitantly) score. J Am Coll Cardiol. 2011;57:173-80. Medlinedoi:10.1016/j.jacc.2010.09.024
Osmancik P, Tousek P, Herman D, et al; PRAGUE-17 Investigators. Interventional left atrial appendage closure vs novel anticoagulation agents in patients with atrial fibrillation indicated for long-term anticoagulation (PRAGUE-17 study). Am Heart J. 2017;183:108-14. Medlinedoi:10.1016/j.ahj.2016.10.003
Holmes DR, Reddy VY, Buchbinder M, et al. The assessment of the WATCHMAN device in patients unsuitable for oral anticoagulation (ASAP-TOO) trial. Am Heart J. 2017;189:68-74. Medlinedoi:10.1016/j.ahj.2017.03.007
Leidraad Linker Hartoor Sluiting. Utrecht: Nederlandse Vereniging voor Cardiologie; 2017.





Reacties