Dames en Heren,
We spreken van primaire amenorroe wanneer de eerste menstruatie, de menarche, niet optreedt vóór de 16e verjaardag of ≥ 5 jaar na het begin van de borstontwikkeling, de thelarche.1,2 De differentiaaldiagnose is uitgebreid waarbij de indeling in 4 compartimenten handvatten geeft voor het diagnostisch traject, ook al bij meisjes < 16 jaar (tabel). Aan de hand van 4 casussen bespreken wij de niet te missen signalen van primaire amenorroe vóór de leeftijd van 16 jaar.

Patiënt A, een meisje van 17 jaar en 7 maanden, werd door de huisarts verwezen naar de gynaecoloog vanwege primaire amenorroe en cyclische buikpijn (regelmatig terugkerende buikpijn conform de menstruatiecyclus). De thelarche had ze rond de leeftijd van 13 jaar. Haar puberteitsontwikkeling volgens Tanner was M4P4 (schaal van 1-5; M staat voor borstontwikkeling; P staat voor pubisbeharing). Bij inspectie van de genitalia externa zagen wij een bomberend hymen (figuur 1c). De groeicurve liet een normale groei zien richting de streeflengte (figuur 2a). We dachten aan een hymen imperforatus met in de differentiaaldiagnose een partiële vaginale agenesie of transversaal vaginaal septum. De abdominale echo liet geen afwijkingen zien van de genitalia interna; onder de uterus was een cysteuze massa zichtbaar van 12,5 bij 7 cm, meest passend bij een hematocolpos.
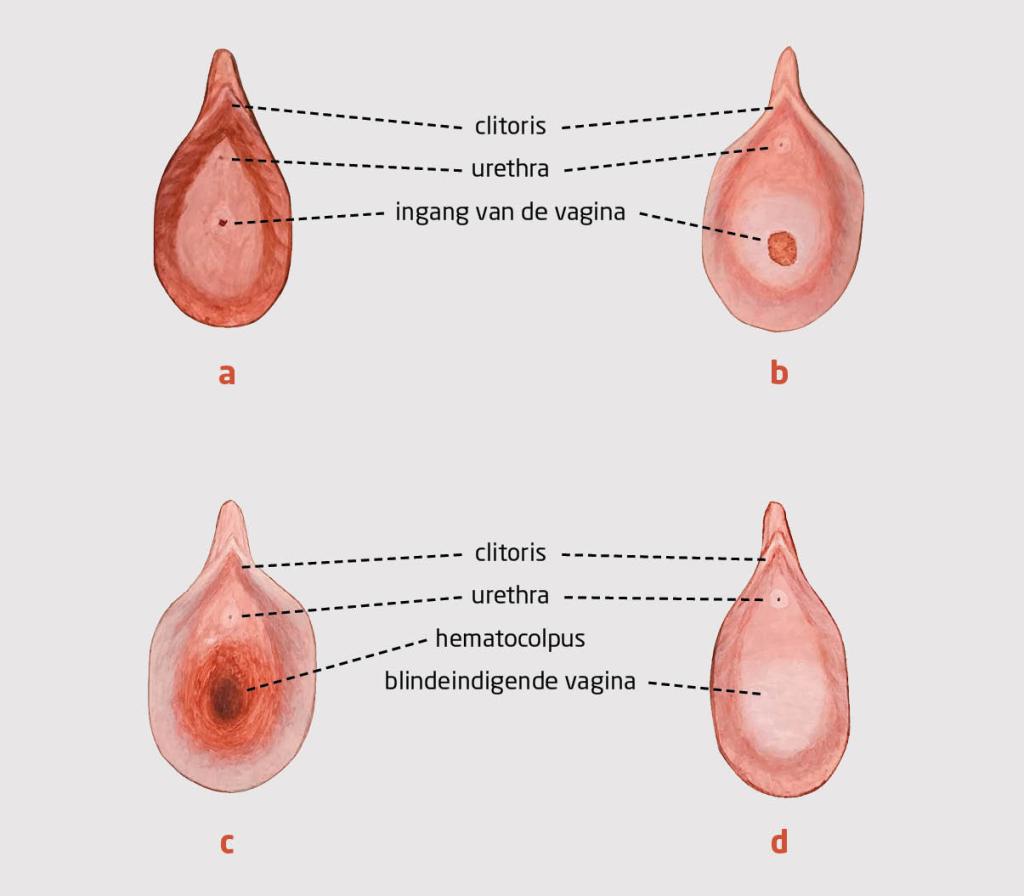
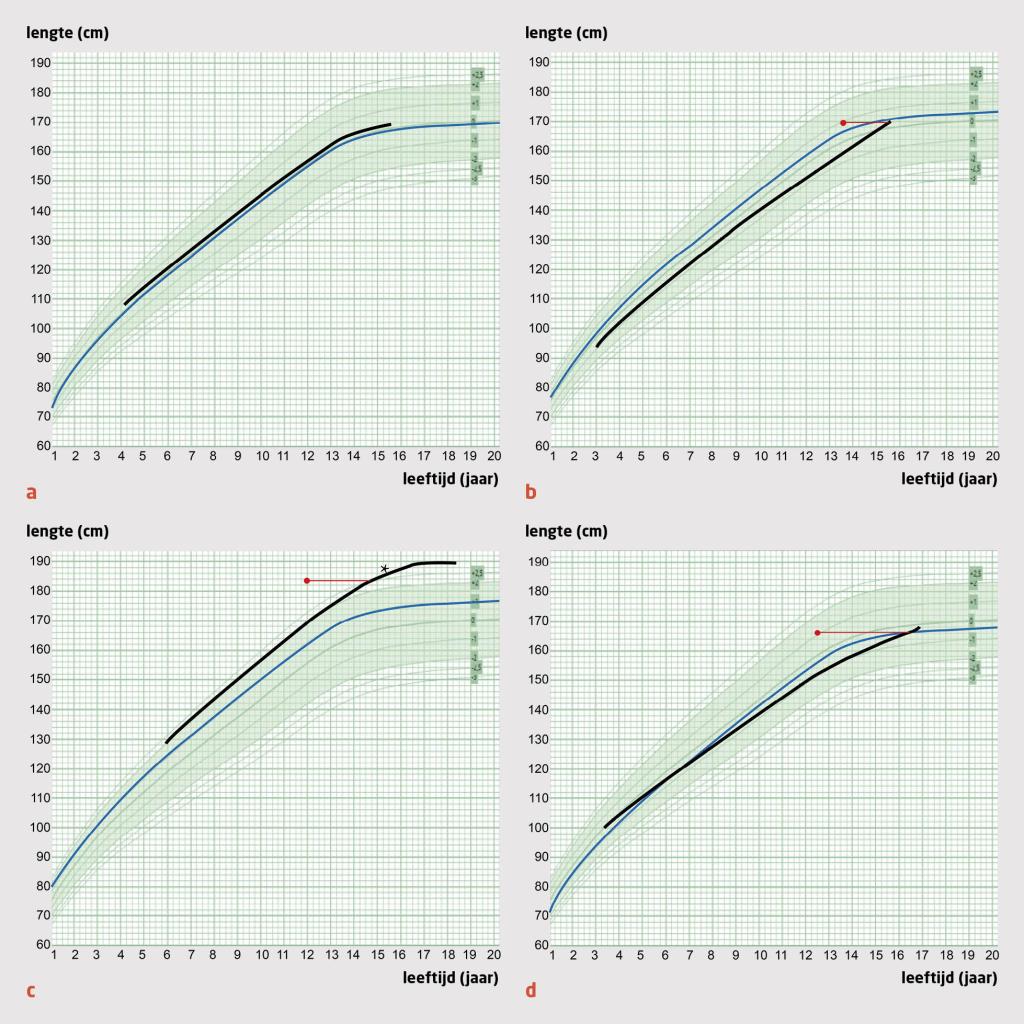
Patiënt B, een meisje van 15 jaar en 11 maanden, werd door de huisarts verwezen naar de kinderarts…




Reacties