Dames en Heren,
Fibro-epitheliale tumoren zijn de meest voorkomende tumoren van de borst en komen voor bij 1 op de 4 vrouwen.1,2 Ze worden onderverdeeld in het veelvoorkomende fibroadenoom en de zeldzame phyllodestumor. De uiteenlopende eigenschappen van deze tumoren zorgen regelmatig voor onzekerheid bij patiënten en behandelaars. Aan de hand van 3 ziektegeschiedenissen en de literatuur beschrijven wij de diagnostiek, behandeling, prognose en nazorg bij patiënten met een fibro-epitheliale tumor.
Patiënt A, een 20-jarige vrouw, kwam op onze polikliniek vanwege een pijnlijke knobbel in haar rechter borst.
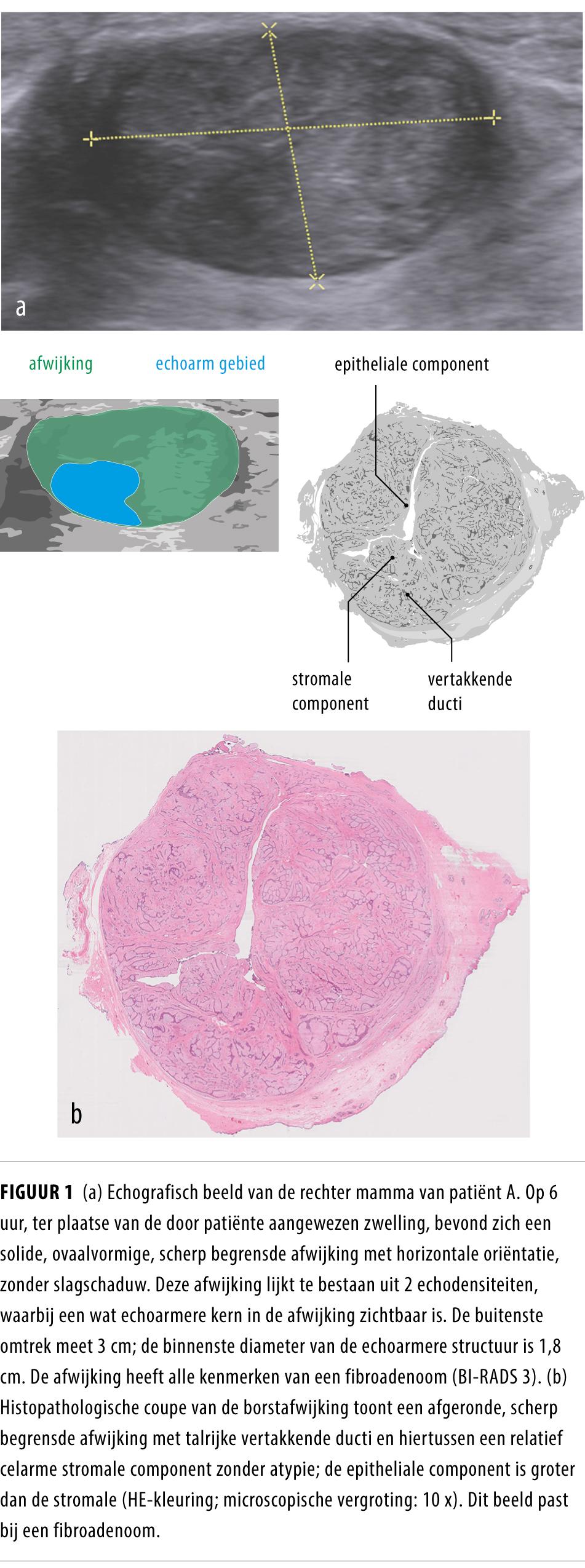
Bij lichamelijk onderzoek zagen wij een niet-zieke vrouw met een palpabele massa in de rechter borst. Echografie liet een scherp afgrensbare, solide structuur van 3 cm zien met een echoarmere kern van 1,5 cm (figuur 1a), wat paste bij een fibroadenoom (BI-RADS-categorie 3; zie uitleg). We voerden een afwachtend beleid.
Echografisch onderzoek na 14 maanden toonde groei van de borsttumor. Een cytologische…





Reacties