Samenvatting
- Bij het herintroduceren van koolhydraten bij ondervoede patiënten kan het 'refeeding'-syndroom optreden. Dit syndroom kenmerkt zich door verlaagde elektrolytenplasmaconcentraties, waarvan hypofosfatemie het vaakst voorkomt. De symptomen kunnen variëren van geringe klachten tot ernstige neurologische of cardiale verschijnselen.
- Het pathofysiologische mechanisme bestaat uit stijging van de insulinewaarde en daardoor verschuiving van fosfaat, kalium en magnesium naar het intracellulaire milieu, vochtretentie en een relatief tekort aan vitamine B1.
- Er is groeiende aandacht voor screening en behandeling van patiënten met ondervoeding, waardoor de incidentie van het refeedingsyndroom waarschijnlijk toeneemt.
- Op dit moment bestaat er geen eenduidige definitie voor dit ziektebeeld en mede hierdoor ontbreekt een solide wetenschappelijke basis voor de screening en behandeling. In dit artikel beschrijven we de rationale van screening en aanvullend laboratoriumonderzoek.
- Prospectief, gecontroleerd onderzoek is van belang om de klinische relevantie van het refeedingsyndroom te definiëren en de behandeling te optimaliseren.
Leerdoelen
- Het refeedingsyndroom kenmerkt zich door het optreden van plasmaelektrolytendeficiënties en vochtretentie na het herintroduceren van koolhydraten bij ondervoede patiënten; hypofosfatemie is hierbij het meest kenmerkend.
- De symptomen van het refeedingsyndroom kunnen variëren van geringe verschijnselen tot ernstige neuromusculaire en cardiale complicaties met zelfs fatale afloop.
- Suppletie van elektrolyten en vitamine B1 en beperking van vocht staan centraal in de behandeling van patiënten met het refeedingsyndroom.
- Er bestaat geen eenduidige definitie van het refeedingsyndroom en mede hierdoor ontbreekt een solide wetenschappelijke onderbouwing voor de screening en behandeling ervan.
- Het opzetten van prospectief vergelijkend onderzoek is van belang om de klinische relevantie van het refeedingsyndroom te definiëren en de behandeling te optimaliseren.
artikel
Een 47-jarige man werd opgenomen vanwege een opvlamming van chronische pancreatitis door alcoholabusus. In de voorafgaande 3 maanden was hij 10 kg afgevallen. Bij lichamelijk onderzoek was hij hemodynamisch stabiel. Hij woog 30 kg (BMI: 10,5 kg/m2). Er waren geen tekenen van decompensatio cordis. De natriumwaarde was 132 mmol/l en de kaliumwaarde 3,1 mmol/l. Hij kreeg pijnstilling, 1000 kcal/dag sondevoeding, dagelijkse suppletie van thiamine 100 mg en multivitamine oraal, en fysiologisch zout 2 l i.v. per 24 h. Naast sondevoeding werd een vrij dieet afgesproken. Op de 4e opnamedag was er sprake van braken, kortademigheid, perifere oedemen en spierzwakte. De hartfrequentie bedroeg 120 slagen/min en de bloeddruk 80/55 mmHg. Hij woog nu 39 kg. Bloedonderzoek toonde de volgende uitslagen: fosfaat: 0,05 mmol/l; kalium: 3,4 mmol/l; calcium: 1,8 mmol/l; albumine: 10,0 g/l; magnesium: 0,2 mmol/l. Hierop stelden wij de diagnose 'refeeding-syndroom'.
Het refeedingsyndroom is een combinatie van verlaagde elektrolytenplasmaconcentraties, met name hypofosfatemie, en vochtretentie die volgt op herintroductie van koolhydraten bij een vastende of ondervoede patiënt. Dit kan optreden na het beginnen met orale voedselinname, sondevoeding of parenterale voeding. De begeleidende symptomen zijn weinig specifiek en kunnen variëren van geringe klachten tot ernstige neurologische of cardiale verschijnselen met zelfs fatale afloop.1-3
Er is maatschappelijk steeds meer aandacht voor de oorzaken, consequenties en kosten van ondervoeding.4 Het is denkbaar dat door een krachtiger beleid tegen ondervoeding het refeedingsyndroom vaker zal worden gezien. Hoewel er in medische en paramedische tijdschriften veel geschreven is over dit ziektebeeld, is er geen consensus over de definitie en behandeling ervan.5 Er wordt niet altijd goed onderscheiden of er sprake is van alleen biochemische gevolgen (hypofosfatemie) of ook klinische verschijnselen door herintroductie van voeding. Meer helderheid over de definitie en de klinische relevantie van dit ziektebeeld is wenselijk.
In dit artikel geven wij een overzicht van het refeedingsyndroom aan de hand van een literatuuronderzoek.
Ondervoeding en refeedingsyndroom in Nederland
Het vóórkomen van ondervoeding in Nederlandse ziekenhuizen en zorginstellingen vertoont een dalende trend. Desondanks rapporteerde de Landelijke Prevalentiemeting Zorgproblemen (LPZ) in 2012 nog een hoge prevalentie van 22% in algemene ziekenhuizen en 17% in verzorgings- en verpleeghuizen. Hogere leeftijd, multimorbiditeit en afhankelijkheid van zorg hangen in de LPZ-meting samen met een verhoogd risico (bron: LPZ-rapport 2012, https://nld.lpz-um.eu/nld/publicaties/rapporten).
Ondervoeding bij patiënten die in het ziekenhuis zijn opgenomen, is gerelateerd aan een langere opnameduur en het optreden van complicaties zoals decubitus en trage wondgenezing; ook is ondervoeding een onafhankelijke voorspeller van overlijden.6 Sinds een aantal jaren zijn de screening (2007) en behandeling (2008) van patiënten met ondervoeding opgenomen in de Basisset Kwaliteitsindicatoren van de Inspectie voor de Gezondheidszorg (bron: www.igz.nl, zoeken op 'kwaliteitsindicatoren ondervoeding').
Voor de screening op ondervoeding zijn verschillende gevalideerde scores samengesteld. In Nederland worden de 'Short nutritional assessment questionnaire(SNAQ)- en de 'Malnutrition universal screening tool(MUST)-score gehanteerd. Hierbij wordt aan de hand van de BMI, het gewichtsverlies en het recente dieet een risicoschatting gemaakt.
In tegenstelling tot bij ondervoeding zijn er geen officiële nationale richtlijnen voor de screening en behandeling van patiënten met het refeedingsyndroom. Een werkgroep van het Nederlands Voedingsteam Overleg, een landelijk overleg van diëtisten, voedingsverpleegkundigen en artsen die werkzaam zijn in een voedingsteam, bracht in januari 2013 op grond van de beschikbare literatuur een document uit dat goed als handleiding kan dienen bij de screening en behandeling van deze patiëntengroep (www.nederlandsvoedingsteamoverleg.nl, kijk onder 'Alle nieuws' naar 'NVOnderwerp Refeeding').
Literatuuronderzoek
We voerden een literatuuronderzoek uit in PubMed; de zoekstrategie staat in de tabel. Dit leverde 399 artikelen op, waarvan een derde relevant was. We excludeerden dierstudies, niet-Engelstalige artikelen en studies bij kinderen. Van de geïncludeerde 131 artikelen waren er 77 casusbeschrijvingen, 21 overzichtsartikelen, 6 vergelijkende studies, 5 klinische trials en 2 systematische reviews. De overige publicaties waren commentaren en ingezonden brieven.

Ziektemechanisme
Tijdens een periode van vasten past het metabolisme zich aan, van een situatie waarin koolhydraatverbranding de voornaamste energiebron vormt naar eiwit- en vetverbranding. Initieel komt glucose vrij uit glycogeen dat is opgeslagen in de lever, maar deze voorraad is na ongeveer 12-24 h uitgeput. Daarnaast zijn er verschillende processen die het lichaam langdurig – tot 30 dagen – van energie kunnen voorzien. Gluconeogenese vindt plaats in de lever en is na het opraken van glycogeen het enige proces dat glucose oplevert. Glucose wordt gevormd uit onder andere ketonen, glycerol en aminozuren, die vrijkomen uit vetweefsel en spieren. Daarnaast worden vrije vetzuren in de lever omgezet in ketonen. Deze vormen een directe energiebron voor verschillende weefsels, waaronder de hersenen.7
Op termijn leidt de afbraak van vetweefsel en spieren tot het verlies van de actieve-celmassa ('lean body mass') met begeleidend verlies van fosfaat, magnesium en kalium die zich hierin bevonden. Dit wordt echter niet weerspiegeld in verlaagde plasmaconcentraties. De combinatie van elektrolyten- en spierweefselverlies leidt onder andere tot een afname van de hartspiercontractiliteit.2,3
Als er weer aanbod is van exogene koolhydraten, treedt snelle stijging van de insulineconcentratie op, waarbij de omzetting van glucose in pyruvaat (glycolyse) in gang wordt gezet (figuur 1). Bij dit proces treedt grootverbruik van fosfaat op door de vorming van ATP. Dat kan leiden tot hypofosfatemie, met daardoor verminderde contractiliteit van glad spierweefsel, inclusief de hartspier, en van skeletspieren, waaronder de ademhalingsspieren. Ook kunnen zich neurologische symptomen voordoen, zoals paresthesieën en insulten.

Onder invloed van insuline kunnen bovendien hypokaliëmie en -magnesiëmie optreden. Insuline leidt tot actief transport van glucose met kalium de cel in vanuit plasma. Magnesium verplaatst zich naar het intracellulaire milieu door verhoogd verbruik als co-enzym bij verschillende metabole processen. De voornaamste symptomen van deze beide deficiënties zijn neuromusculaire stoornissen en hartritmestoornissen.
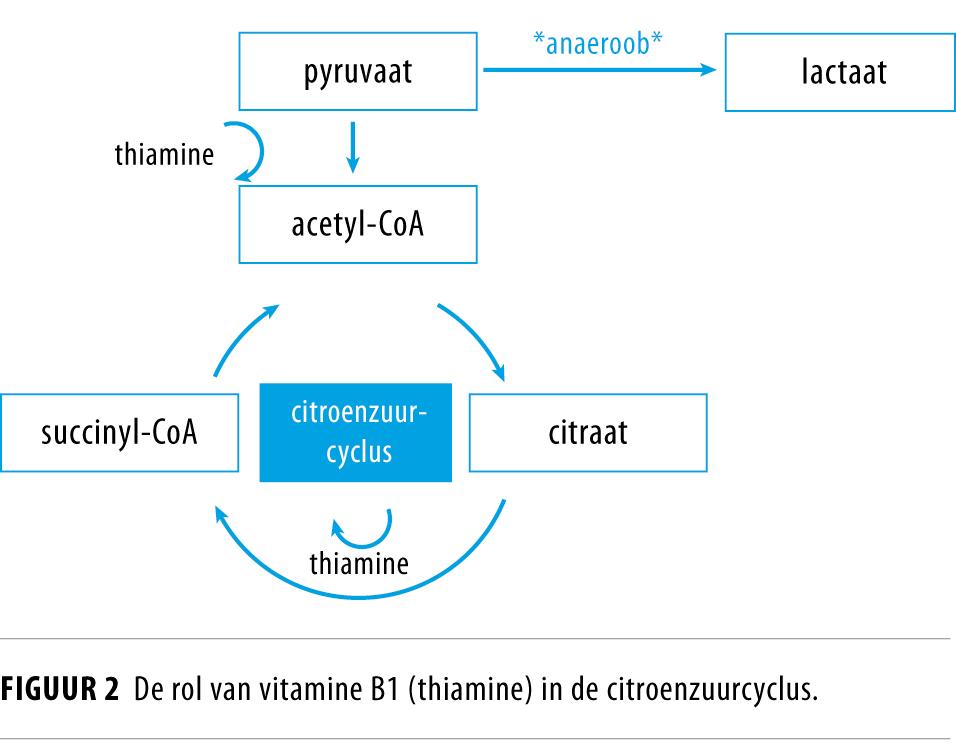
Een hoge insulineconcentratie stimuleert daarnaast natrium- en vochtretentie. In combinatie met een verlaagde pompfunctie van het hart kan dit leiden tot decompensatio cordis. Tot slot neemt tijdens de glycolyse het verbruik van vitamine B1 (thiamine) sterk toe, omdat dit een belangrijk co-enzym is in deze cyclus Een deficiëntie ontstaat snel, omdat het menselijk lichaam weinig opslagcapaciteit heeft voor deze vitamine. Bij thiaminegebrek kan pyruvaat niet de citroenzuurcyclus in en wordt het omgezet in lactaat (figuur 2). Een ernstig thiaminetekort kan daarnaast leiden tot Wernicke-encefalopathie en beriberi.3,5,8
Epidemiologie
Incidentie
Het is moeilijk om een uitspraak te doen over de incidentie van het refeedingsyndroom, omdat er geen vaste definitie gehanteerd wordt in de literatuur. In veel studies bestaat de definitie uit levensbedreigende biochemische veranderingen na herintroductie van voeding bij een ondervoede patiënt, zonder dat er objectieve parameters en klinische verschijnselen worden genoemd.
In een prospectief onderzoek onder 62 IC-patiënten die 48 h hadden gevast, ontwikkelde 10% ernstige hypofosfatemie (fosfaat: < 0,32 mmol/l) na het beginnen met kunstmatige voeding.9 Bij ruim 300 patiënten werd gekeken naar de daling van de fosfaatwaarde na het introduceren van kunstmatige enterale of parenterale voeding.10 Bij 15% van de patiënten trad een belangrijke daling van de fosfaatwaarde op van meer dan 0,6 mmol/l. Hypofosfatemie trad significant vaker op bij enteraal gevoede patiënten (33 vs. 13%). De theoretische verklaring daarvoor is tweeledig. Ten eerste wordt glucose sneller enteraal opgenomen dan fosfaat. Hierdoor treedt glycolyse op zonder dat het fosfaat dat daarbij wordt verbruikt, wordt gecompenseerd. Daarnaast leidt het modulerende effect van incretine in de darm tot een hogere insulinerespons bij een enteraal glucoseaanbod dan bij parenteraal toegediende glucose.10
In slechts een enkel onderzoek worden de klinische symptomen, zoals perifeer oedeem, acute overvulling of een orgaanfunctiestoornis, meegenomen in de definitie van het refeedingsyndroom. In het genoemde prospectieve onderzoek ontwikkelden 3 van de 243 patiënten (1,2%) die ten minste 24 h kunstmatig gevoed werden op verpleeg- en IC-afdelingen, het refeedingsyndroom.11 De resultaten zijn echter niet te generaliseren, omdat de helft van de patiënten werd geëxcludeerd, voornamelijk vanwege het ontbreken van informed consent, vroegtijdig ontslag en het verwijderen van de sonde. Het is interessant dat deze patiënten de helft van de energiebehoefte kregen als zij op basis van dieetanalyse een verhoogd risico op het refeedingsyndroom hadden. Alle 3 de patiënten bij wie het refeedingsyndroom optrad vielen in deze groep en ontwikkelden dus ernstige symptomen, ondanks verlaging van het voedingsaanbod.11
Risicogroepen
Ondervoeding komt het vaakst voor onder ouderen, alcoholisten en patiënten met een chronische ziekte (kanker, hiv, malabsorptie), met anorexia nervosa of na bariatrische chirurgie. Deze patiëntengroepen lopen een hoog risico op het ontwikkelen van het refeedingsyndroom. Ook vasten gedurende ten minste 7 dagen of het gebruik van antacida of diuretica, waarbij elektrolytenverlies via respectievelijk de darm en de nier optreedt, leidt vaker tot het refeedingsyndroom.12
Screening en behandeling
In de beschikbare literatuur is er overeenstemming dat de essentie van de behandeling van patiënten met het refeedingsyndroom de preventie van het syndroom is.8,12-16 Het signaleren van patiënten die risico lopen op het ontwikkelen van het refeedingsyndroom maakt preventieve maatregelen mogelijk.
In verschillende onderzoeken worden adviezen gegeven over het monitoren van biochemische en klinische parameters tijdens herintroductie van voeding om het refeedingsyndroom vroeg op te sporen. Alle adviezen zijn gebaseerd op casusbeschrijvingen en meningen van experts. Het gaat om het dagelijks bepalen van de fosfaat-, kalium- en magnesiumconcentratie in plasma. Ter voorkoming van overvulling wordt geadviseerd om een vochtbeperking van 20-30 ml/kg per dag te hanteren en dagelijks het gewicht, de bloeddruk, de hartfrequentie en de aanwezigheid van oedeem te beoordelen. De duur van de monitoring loopt uiteen van 7-10 dagen.8,12-16
In diverse reviews wordt geadviseerd om bij risicopatiënten te beginnen met een gereduceerde voedingsdosering, variërend van 5-10 kcal/kg (referentiewaarde: ongeveer 30 kcal/kg) en het aanbod stapsgewijs uit te breiden. Hiervoor is echter geen wetenschappelijk bewijs en desondanks kunnen complicaties optreden.11 Daarnaast blijkt dat het snel introduceren van koolhydraten veilig kan zijn, maar deze studie heeft als kanttekening dat het merendeel (65%) IC-patiënten betrof.17 Bij 51 patiënten van wie een derde ernstig ondervoed was, werd de totale energiebehoefte door toediening van sondevoeding binnen 24 h bereikt. Bij 80% van de hele groep en 93% van de ernstig ondervoede patiënten traden elektrolytstoornissen op, maar geen enkele ging gepaard met respiratoire of cardiale complicaties. Snelle toediening van koolhydraatrijke voeding kan dus leiden tot biochemische veranderingen, maar hoeft niet samen te gaan met klinische verschijnselen. De resultaten zijn echter niet te extrapoleren naar de hele ziekenhuispopulatie.17
Wel is goed uitgezocht dat thiaminetoediening complicaties voorkomt bij het introduceren van voeding bij risicopatiënten. In de meeste artikelen wordt geadviseerd om te beginnen met thiamine 300 mg, gevolgd door thiamine 100 mg gedurende 10 dagen in totaal.13
De optimale behandeling van patiënten met het refeedingsyndroom is niet systematisch onderzocht. Op basis van casusbeschrijvingen en expertise wordt geadviseerd om de voeding te staken als het syndroom optreedt. Daarnaast wordt correctie van elektrolyttekorten en herstel van de vochtbalans voorgeschreven. Een mogelijk schema voor suppleren van elektrolyten en thiamine is te vinden in het eerder genoemde document van het Nederlands Voedingsteam Overleg. Hervatting van de voeding wordt pas verantwoord geacht als de elektrolytenplasmaconcentraties genormaliseerd zijn en euvolemie is bereikt.8,12-16
Prospectief onderzoek nodig
Ondervoeding komt veel voor bij patiënten die in het ziekenhuis worden opgenomen; behandeling voorkomt complicaties en verkort de opnameduur. Het is daarnaast duidelijk dat ondervoede of vastende patiënten risico lopen op ernstige symptomen door herintroductie van koolhydraten. Het detecteren van risicopatiënten en het monitoren van het gewicht en de elektrolytenconcentraties kunnen helpen de eerste tekenen te herkennen en daarmee ernstige uitingen van het refeedingsyndroom te voorkómen.
Hoewel er veel geschreven is over het refeedingsyndroom in medische en paramedische tijdschriften, is er geen eenduidige definitie en ontbreekt solide wetenschappelijke onderbouwing voor de wijze van screening en behandeling. In de systematisch opgezette onderzoeken die wij vonden, zijn de resultaten moeilijk te vergelijken door kleine patiëntgroepen en verschillen in de onderzoekspopulaties, definities, behandelwijzen en uitkomstmaten. Er zijn veel casusbeschrijvingen over de ernstige gevolgen van het refeedingsyndroom, maar daarbij moet rekening gehouden worden met een publicatiebias. De klinische relevantie is nog onvoldoende opgehelderd.
Desondanks wordt in veel ziekenhuizen dagelijks gescreend op het ontstaan van het refeedingsyndroom bij risicopatiënten. Het is niet duidelijk of de kosten en de eventuele negatieve gevolgen van screening (bloedafname, uitstellen adequate voeding) in verhouding staan tot de risico's van het optreden van het refeedingsyndroom.
Er is dus behoefte aan een prospectieve multicentrische studie waarin ondervoede of vastende patiënten worden behandeld met verschillende voedingsregimes. Daarbij moeten vooral klinische parameters, zoals spierkrachtmeting, optreden van insulten, oedemen, gewichtstoename > 1 kg per week en respiratoire insufficiëntie, worden meegenomen; deze zijn gerelateerd aan het optreden van elektrolytendeficiënties of de mate van de deficiëntie. De uitkomsten hiervan kunnen helpen bij een nieuwe definiëring van het syndroom met objectieve waardes voor elektrolytstoornissen en duidelijk omschreven klinische parameters. Er kan bijvoorbeeld gedacht worden aan het ontwikkelen van een scoresysteem waarbij zowel elektrolytendeficiënties als klinische symptomen gezamenlijke criteria zijn en punten opleveren.
Voor het verhelderen van de relevantie van het refeedingsyndroom is er bovendien behoefte aan onderzoek naar klinische uitkomstmaten als opnameduur, morbiditeit en mortaliteit.
Wij hopen dat verheldering van de klinische relevantie van het refeedingsyndroom uiteindelijk leidt tot beter onderbouwde screening en behandeling en mogelijk tot reductie van de kosten.
Literatuur
- Silvis SE, Paragas PD Jr. Paresthesias, weakness, seizures, and hypophosphatemia in patients receiving hyperalimentation. Gastroenterology. 1972;62:513-20 Medline.
- Brozek J, Chapman CB, Keys A. Drastic food restriction; effect on cardiovascular dynamics in normotensive and hypertensive conditions. J Am Med Assoc. 1948;137:1569-74. doi:10.1001/jama.1948.02890520001001Medline
- Weinsier RL, Krumdieck CL. Death resulting from overzealous total parenteral nutrition: the refeeding syndrome revisited. Am J Clin Nutr. 1981;34:393-9 Medline.
- Van Steenbergen E. Iedere dag sterft minstens één Nederlander aan ondervoeding. NRC 9 september 2014.
- Crook MA. Refeeding syndrome: problems with definition and management. Nutrition. 2014;30:1448-55. doi:10.1016/j.nut.2014.03.026Medline
- Correia MI, Waitzberg DL. The impact of malnutrition on morbidity, mortality, length of hospital stay and costs evaluated through a multivariate model analysis. Clin Nutr. 2003;22:235-9. doi:10.1016/S0261-5614(02)00215-7Medline
- Longo VD, Mattson MP. Fasting: molecular mechanisms and clinical applications. Cell Metab. 2014;19:181-92. doi:10.1016/j.cmet.2013.12.008Medline
- Stanga Z, Brunner A, Leuenberger M, et al. Nutrition in clinical practice-the refeeding syndrome: illustrative cases and guidelines for prevention and treatment. Eur J Clin Nutr. 2008;62:687-94. doi:10.1038/sj.ejcn.1602854Medline
- Marik P, Bedigian MK. Refeeding hypophosphatemia in critically ill patients in an Intensive Care Unit. A prospective study. Arch Surg. 1996;131:1043-7. doi:10.1001/archsurg.1996.01430220037007Medline
- Zeki S, Culkin A, Gabe SM, Nightingale JM. Refeeding hypophosphataemia is more common in enteral than parenteral feeding in adult in patients. Clin Nutr. 2011;30:365-8. doi:10.1016/j.clnu.2010.12.001Medline
- Rio A, Whelan K, Goff L, Reidlinger DP, Smeeton N. Occurrence of refeeding syndrome in adults started on artificial nutrition support: prospective cohort study. BMJ Open. 2013;3:e002173. doi:10.1136/bmjopen-2012-002173Medline
- Mehanna HM, Moledina J, Travis J. Refeeding syndrome: what it is, and how to prevent and treat it. BMJ. 2008;336:1495-8. doi:10.1136/bmj.a301Medline
- Boateng AA, Sriram K, Meguid MM, Crook M. Refeeding syndrome: treatment considerations based on collective analysis of literature case reports. Nutrition. 2010;26:156-67. doi:10.1016/j.nut.2009.11.017Medline
- Kraft MD, Btaiche IF, Sacks GS. Review of the refeeding syndrome. Nutr Clin Pract. 2005;20:625-33. doi:10.1177/0115426505020006625Medline
- Brooks MJ, Melnik G. The refeeding syndrome: an approach to understanding its complications and preventing its occurrence. Pharmacotherapy. 1995;15:713-26 Medline.
- Solomon SM, Kirby DF. The refeeding syndrome: a review. JPEN J Parenter Enteral Nutr. 1990;14:90-7. doi:10.1177/014860719001400190Medline
- Flesher ME, Archer KA, Leslie BD, McCollom RA, Martinka GP. Assessing the metabolic and clinical consequences of early enteral feeding in the malnourished patient. JPEN J Parenter Enteral Nutr. 2005;29:108-17. doi:10.1177/0148607105029002108Medline




Reacties