Samenvatting
Achtergrond
Het flankpijn-hematuriesyndroom wordt gekenmerkt door aanvallen van flankpijn en micro- of macroscopische hematurie zonder een urologische oorzaak.
Casus
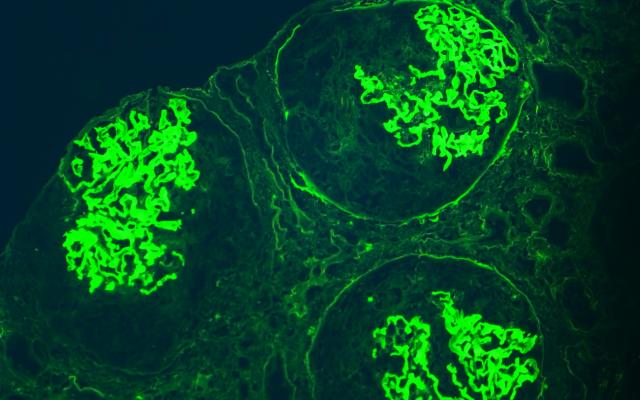
Wij presenteren een 39-jarige vrouw die naar ons werd verwezen vanwege sinds 20 jaar aanwezige microscopische hematurie en proteïnurie zonder duidelijke oorzaak. Sinds 9 maanden had zij ook continue flankpijn, die verergerde bij inspanning. Aanvullend onderzoek liet erytrocyten in de niertubuli en een dun glomerulair basaalmembraan zien. Hierop stelden we de diagnose ‘flankpijn-hematuriesyndroom op basis van dunne-basaalmembraannefropathie’.
Conclusie
Het flankpijn-hematuriesyndroom is een potentieel invaliderende aandoening. Door onbekendheid wordt dit ziektebeeld vaak niet goed herkend. De behandeling bestaat uit uitleg, ACE-remming, pijnstilling en cognitieve gedragstherapie. Bij persisterende invaliderende pijn kan renale denervatie van de nierslagader overwogen worden.



Reacties