artikel
‘Niet besmet, toch positief getest’ kopte NRC Handelsblad op 11 september. Sindsdien is er discussie over de specificiteit van de PCR-test voor SARS-CoV-2. Voor elke diagnostische test geldt dat een suboptimale specificiteit problematisch is wanneer de prevalentie van de ziekte daalt: op een gegeven moment zijn er meer fout-positieven dan zieken. Maar geldt dat ook voor de PCR-test voor SARS-CoV-2? Hoe werkt die test en wanneer spreken we van een positieve uitslag? En hoe problematisch is dat? Een bericht uit het lab waar ik bijles kreeg van mijn collega arts-microbioloog Marije Hofstra.
De test
Veel laboratoria hebben – op hun eigen manier – in februari en maart van dit jaar een infrastructuur opgetuigd in het kader van de PCR-test voor SARS-CoV-2, met als primaire doel om het virus zo snel mogelijk aan te tonen. Daarvoor wil je vooral een hoge sensitiviteit. Bij de PCR-test voor SARS-CoV-2 gebruiken we in het UMC Utrecht 3 stukjes van het RNA-genoom (het E-, N- en RdRP-gen). De wattenstaaf gaat in keel en neus, dan in een vloeistof en vervolgens naar het lab. Aldaar wordt het RNA geëxtraheerd, waarna het amplificeren van de targets kan beginnen. De ‘cycle threshold’(Ct)-waarde is het aantal amplificatiecycli dat nodig is voor een positief signaal, gemeten als een curve die boven een drempel uitkomt. Analisten zijn getraind in het beoordelen van deze curves om de beoordeling zo uniform mogelijk te maken. Als er na 45 cycli nog steeds niks geamplificeerd is, is de testuitslag negatief.
Een positieve uitslag
Wanneer vinden wij in het UMC Utrecht de testuitslag positief? Hebben alle targets een Ct-waarde < 35 en worden er goede curves gezien, dan is er geen discussie: de testuitslag is positief. Bij Ct-waarden ≥ 35 wordt het lastig en regelmatig hebben 1-2 targets een dergelijke Ct-waarde regelmatig. Curves die in de laatste amplificatiecycli opkomen zijn soms moeilijk te interpreteren, en bij twijfel wordt de test herhaald. Vaak is de uitslag dan opnieuw zwak positief, wat dan toch echt op aanwezigheid van viraal RNA duidt. Wij noemen de testuitslag dan ‘voorlopig positief’. De interpretatie van de curves blijft mensenwerk, en er is dus een kans op een fout-positieve uitslag. Hoe groot die kans precies is, is moeilijk vast te stellen. Daarvoor zou je de test moeten uitvoeren bij duizenden mensen van wie je zeker weet dat ze niet besmet zijn. Onze voorlopig positieve uitslagen verschijnen in de landelijke database – die geraadpleegd wordt door de GGD’en – als ‘positief’, met de opmerking dat er slechts kleine hoeveelheden viraal RNA zijn aangetoond.
De Ct-waarde
De Ct-waarde zegt dus iets over de hoeveelheid RNA in het onderzochte materiaal: een lage Ct-waarde betekent veel viraal RNA, een hoge waarde duidt op weinig viraal RNA. Om die reden hangt de Ct-waarde af van hoeveel virus er in de keel zit en hoeveel daarvan op de wattenstaaf terechtkomt. Dat laatste wordt bepaald door de manier waarop het materiaal wordt afgenomen en vervolgens verwerkt wordt. Hoeveel virus er in de keel zit is afhankelijk van het ziektestadium: na transmissie gaat het virus zich repliceren en neemt de virusconcentratie (‘viral load’) toe, en zodra het afweersysteem de infectie onder controle krijgt neemt de virusconcentratie weer af (figuur). Het rest-RNA van het virus kan nog lang detecteerbaar blijven.
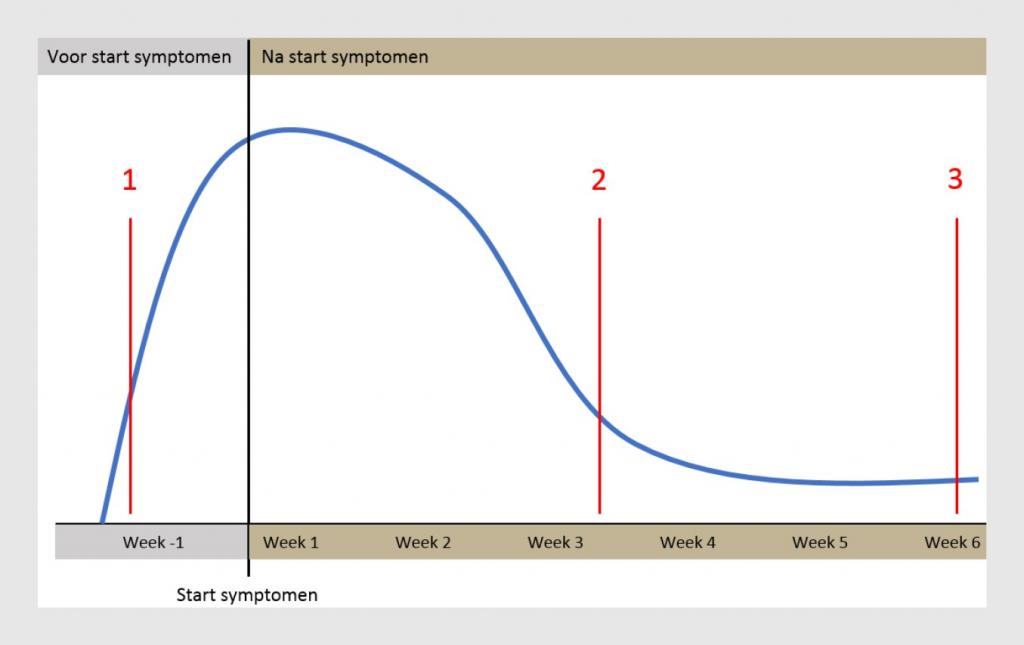
Wanneer is iemand besmettelijk? Als het virus gekweekt kan worden, bevat het materiaal virus dat zich kan repliceren, en dan gaan we ervan uit dat iemand besmettelijk is. Maar het kweken van een virus duurt meerdere dagen en wordt alleen in een onderzoekssetting uitgevoerd. We weten inmiddels dat het virus langere tijd te kweken is bij patiënten met ernstigere symptomen. In studies lukte het kweken niet meer wanneer de Ct-waarde > 29 is. Maar de Ct-waarde kan per monster en per lab verschillen, dus is er geen afkappunt voor besmettelijkheid.
In de praktijk
Na zo’n 60.000 testen zagen we bij ongeveer een kwart van de positieve testuitslagen (400 van bijna 1600) een Ct-waarde > 35 bij één of meerdere targets. De kans op zo’n uitslag is natuurlijk kleiner wanneer niet op 3 maar op 2 targets getest wordt, zoals veel laboratoria doen. Zwak positieve testuitslagen kunnen in werkelijkheid fout-positief zijn, maar ze kunnen ook passen bij een vroege of doorgemaakte infectie (zie de figuur). Om dan de uitslag juist te kunnen interpreteren, heb je aanvullende informatie van de patiënt nodig. Bij een vroege infectie zal de patiënt waarschijnlijk nog besmettelijk worden en adviseren we om de test te herhalen. In de andere gevallen is de patiënt mogelijk niet infectieus. Technisch gezien gaat het dan niet om fout-positieve uitslagen, maar als patiënten niet meer besmettelijk zijn verdwijnt de noodzaak voor isolatie van de indexpatiënt en quarantaine van zijn of haar contacten.
In de monsters die wij via de GGD-teststraat kregen, was bij ongeveer 75% van de positieve uitslagen getest op 3 targets en lag de gemiddelde Ct-waarde op 22-24. In het kader van het bron- en contactonderzoek werd in een steekproef van deze positieve uitslagen bij 75% een positief geteste bron of een positief getest contact gevonden. Bron- en contactonderzoek bij 72 patiënten met een zwak positieve testuitslag leverde vrijwel geen nieuwe positief geteste contacten op. De opbrengst van het bron- en contactonderzoek lijkt bij deze groep dus beperkt
Tot slot
Als we dan toch een uitspraak moeten doen over de kans op een fout-positieve uitslag: die lijkt in elk geval kleiner dan 0,67% (400 van 60.000). Omdat ook hoge Ct-waarden vaak op aanwezigheid van RNA van SARS-CoV-2 duiden, lijkt die kans aanzienlijk lager, maar 100% zekerheid daarover hebben we niet. ‘Niet besmet, toch positief getest’ lijkt een zeldzaamheid. ‘Niet besmettelijk, toch positief getest’ komt daarentegen waarschijnlijk regelmatig voor. Nu we meer inzicht in covid-19 krijgen, kunnen we de testuitslagen beter interpreteren. Het doel van het testbeleid is om transmissie zoveel mogelijk te beperken door zoveel mogelijk verspreiders te traceren en te isoleren. Het missen van mensen met een laag risico op verspreiding is geen ramp en is zelfs te verkiezen als daardoor middelen vrijkomen om meer verspreiders te vinden. Alleen nog maar bron- en contactonderzoek doen bij patiënten met een overtuigend positieve PCR-testuitslag kan de inzet van de GGD verder optimaliseren.





Reacties