Samenvatting
-
Bruin vetweefsel zet energie die opgeslagen ligt in triglyceriden om in warmte via het zogenoemde ontkoppelingseiwit UCP-1.
-
Recentelijk is ontdekt dat bruin vetweefsel aanwezig en actief is bij volwassenen. Het bevindt zich voornamelijk rond de aorta en in het supraclaviculaire gebied.
-
Het volume en de activiteit van bruin vet is lager bij obese mensen. Dit suggereert dat bruin vetweefsel sterk bijdraagt aan het totale energiegebruik.
-
Verschillende aandoeningen die gepaard gaan met activatie van bruin vetweefsel, zoals hyperthyreoïdie en feochromocytomen, leiden tot verhoogd energiegebruik en gewichtsverlies.
-
Er zijn diverse manieren ontdekt waarop bruin vetweefsel gemanipuleerd kan worden om het energiegebruik te verhogen. Voorbeelden zijn blootstelling aan kou, het gebruik van ‘ontkoppelaars’ of de toediening van het hormoon irisine.
-
Stimulatie van bruin vetweefsel zou mogelijk gebruikt kunnen worden om af te vallen.
artikel
Vetweefsel kan onderscheiden worden in ‘wit vet’ en ‘bruin vet’. Tot voor kort werd gedacht dat bruin vet bij volwassenen niet meer aanwezig is. Met moderne technieken als 18F-fluorodeoxyglucose(FDG)-PET-CT-scans is echter het tegendeel bewezen. Recent werd ontdekt dat bruin vet gemanipuleerd kan worden om het energiegebruik te verhogen.
De functie van het witte vet is het opslaan van triglyceriden en het produceren van een groot aantal factoren, de zogenoemde adipocytokinen, kortweg ‘adipokinen’.1 Bruin vet verbrandt juist continu in meer of mindere mate triglyceriden en glucose, waarbij de gevormde energie als warmte vrijkomt en verloren gaat. Dit fenomeen heet thermogenese. Bij neonaten draagt dit in belangrijke mate bij aan het handhaven van de lichaamstemperatuur.
In dit artikel geven wij een overzicht van de anatomie, fysiologie en functie van bruin vet en zetten we uiteen hoe bruin vet gemanipuleerd kan worden om het energiegebruik te verhogen en mogelijk gewichtsverlies te induceren.
Anatomie en oorsprong van bruin vet
Bruin vet verschilt sterk van wit vet in volume en structuur (tabel). Bij een volwassene wordt de totale hoeveelheid bruin vet geschat op 50-100 g, terwijl de hoeveelheid wit vet grofweg 20% van het lichaamsgewicht bedraagt. Een witte vetcel bestaat uit een grote vacuole gevuld met triglyceriden, omringd door een dun randje cytoplasma. In dit dunne randje bevinden zich de celkern en de celorganellen, waaronder enkele mitochondriën die zorgen voor de vorming van ATP, de belangrijkste energieleverancier van lichaamscellen. Een bruine vetcel bevat meerdere kleine vetdruppels die omgeven zijn door grote hoeveelheden mitochondriën. Daarin bevinden zich ijzerhoudende eiwitten, die onderdeel zijn van de ademhalingsketen. Deze mitochondriën geven het bruine vet zijn kleur.
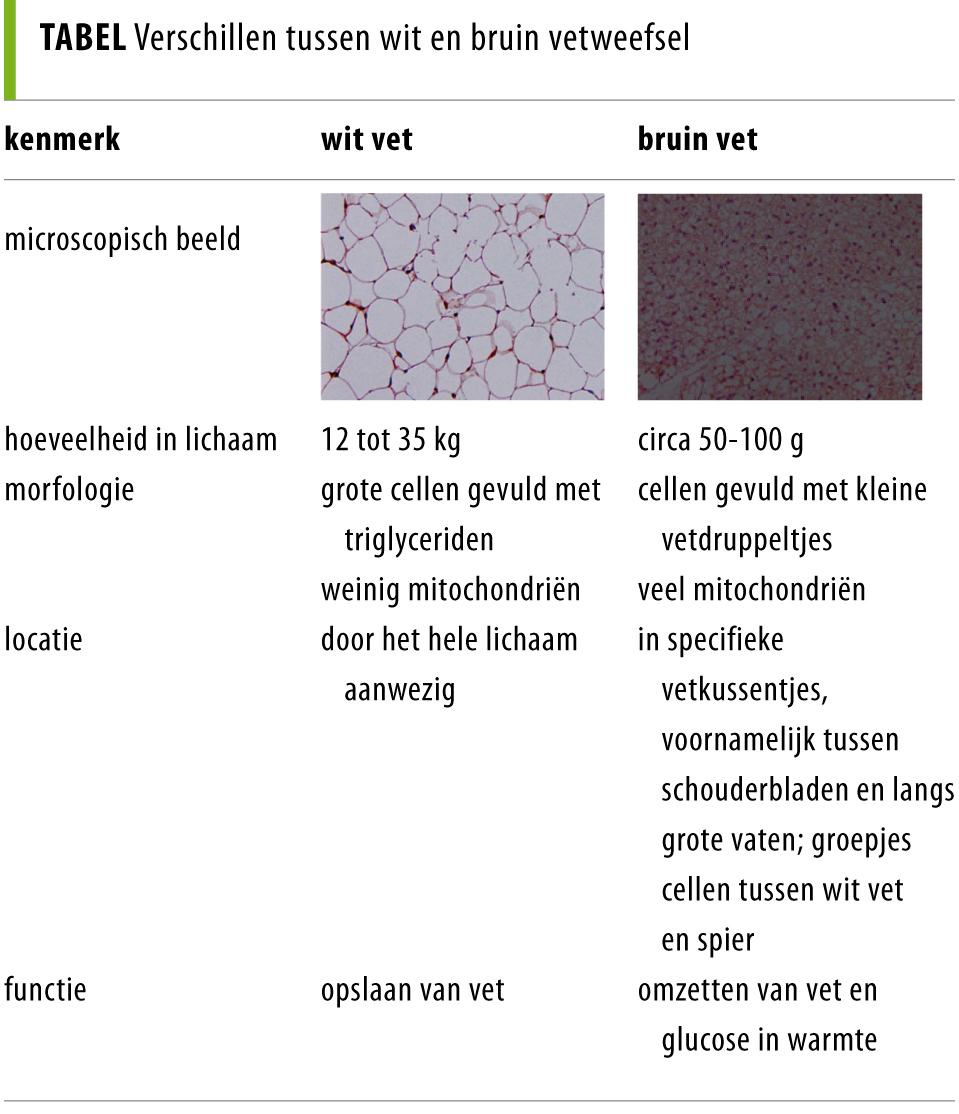
Bruine vetcellen zijn in 2 vormen aanwezig. Enerzijds vormen ze gezamenlijk bruine vetkussentjes die zich bij neonaten tussen de schouderbladen bevinden, en bij volwassenen langs de aorta en in het supraclaviculaire gebied.2 Anderzijds komen bruine vetcellen verspreid in andere weefsels voor, zoals in wit vetweefsel en spierweefsel; dit zijn zogenoemde ‘perifere bruine vetcellen’. Deze worden ook wel ‘beige vetcellen’ genoemd, omdat ze fenotypisch tussen een witte en bruine vetcel in zitten.
Ontstaanswijze
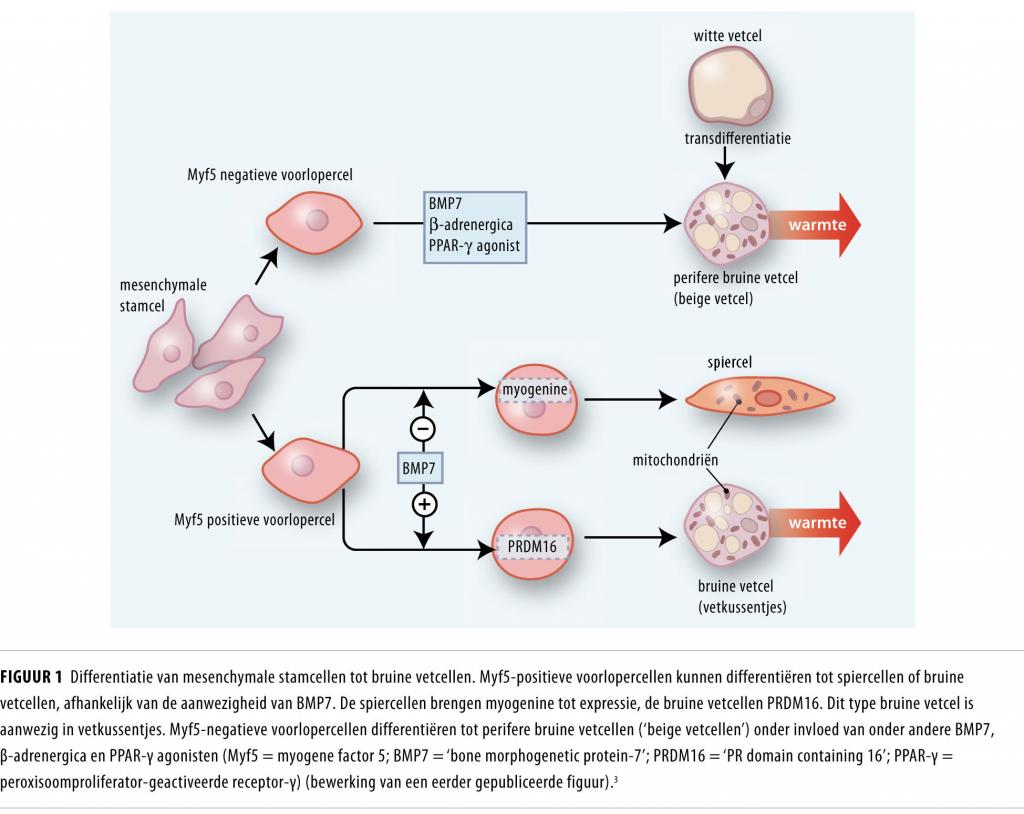
De 2 typen bruine vetcellen hebben een verschillende ontstaanswijze (figuur 1). De bruine vetcel in de vetkussentjes ontstaat uit een voorlopercel die positief is voor de myogene factor 5 (Myf5). Deze voorlopercel kan differentiëren tot zowel een bruine vetcel als een spiercel; deze differentiatie is afhankelijk van de aanwezige stimuli, waaronder het ‘bone morphogenetic protein 7’ (BMP-7). De perifere bruine vetcel – of beige vetcel – ontstaat uit een Myf5-negatieve voorlopercel, maar ook uit transdifferentiatie van een witte vetcel naar een bruine vetcel.3,4 Verscheidene stimuli (zoals BMP-7, β-adrenergica en peroxisoomproliferator-geactiveerde receptor-γ(PPAR-γ)-agonisten) kunnen de differentiatie van voorlopercellen tot perifere bruine vetcellen stimuleren.3 Deze stimuli worden dan ook als interessante therapeutische aanknopingspunten beschouwd.
Fysiologie van bruin vet
In mitochondriën vindt ATP-synthese plaats. Dit proces begint met de omzetting van vetzuren en glucose in acetylco-enzym A, dat in het mitochondrium deelneemt aan de citroenzuurcyclus. Hierbij ontstaan energierijke verbindingen, zoals NADH en FADH2, die in het proces van oxidatieve fosforylering hun elektronen afgeven aan de elektronentransportketen. Daardoor wordt over de binnenmembraan van het mitochondrium een gradiënt van H+-ionen opgebouwd (figuur 2). De energie van deze gradiënt wordt gebruikt door het enzym ATP-synthetase om ADP om te zetten in ATP.
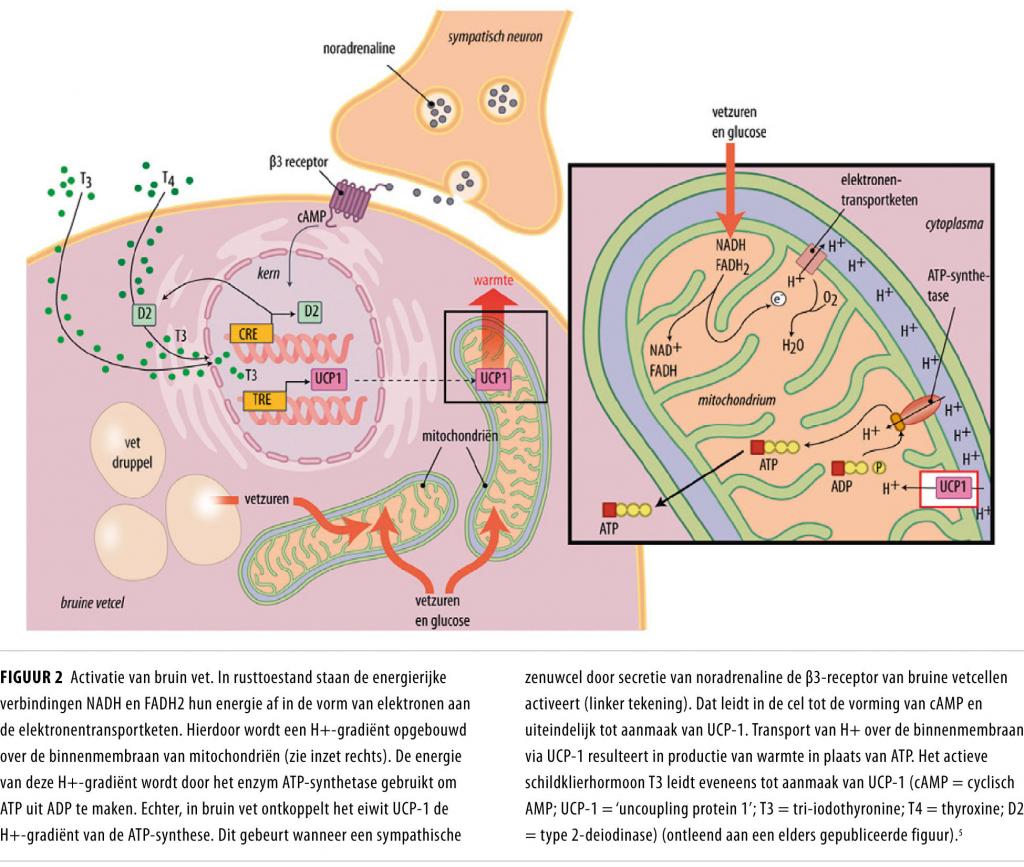
Het bijzondere van de bruine vetcel is dat deze cel triglyceriden en glucose kan verbranden via zogenoemde ontkoppeling. Hierbij komt energie als warmte vrij in plaats van als ATP, terwijl het energiegebruik in de cel toeneemt. De werking van een bruine vetcel is afgebeeld in figuur 2.
Iedere bruine vetcel wordt geïnnerveerd door een sympathische zenuwcel. De belangrijkste stimulator van deze zenuwcel is kou; de zenuwcel wordt geactiveerd door het temperatuurcentrum in de hersenen, dat input krijgt vanuit sensibele zenuwen in de huid. Na stimulatie geeft het zenuwuiteinde noradrenaline af, dat bindt aan β3-receptoren op de bruine vetcel. Activatie van deze receptoren zet een cascade van intracellulaire reacties op gang.
Ontkoppelingseiwit Ten eerste wordt via verhoging van intracellulair cyclisch AMP de expressie geïnduceerd van het gen voor het ontkoppelingseiwit UCP-1 (‘uncoupling protein 1’). Dit eiwit komt alleen in bruin vetweefsel voor. UCP-1-moleculen worden vervolgens ingebouwd in de binnenmembraan van mitochondriën, waar ze poriën vormen. Door deze poriën van UCP-1 wordt de protongradiënt verstoord (zie figuur 2), waardoor de opgebouwde energie vervliegt als warmte, zonder dat ATP wordt gevormd. Hoe groter de dichtheid van de mitochondriën of de hoeveelheid UCP-1 in het bruine vet, des te meer glucose en triglyceriden verbrand worden en omgezet worden tot warmte bij activatie van het bruine vet.
Toename substraat Tegelijkertijd leidt sympathische activatie van bruin vetweefsel ook tot een verhoogde hoeveelheid en activiteit van het enzym lipoproteïnelipase (LPL), dat vetzuren afsplitst van triglyceriden voor opname door bruin vet, en van glucosetransporter type 1 (GLUT-1), die de opname van glucose door bruin vetweefsel verhoogt.6 Op die manier verhoogt sympathische activatie van bruin vet niet alleen de thermogenese maar ook de influx van het benodigde substraat.
Schildklierhormoon Opvallend is de betrokkenheid van schildklierhormoon in de activatie van bruin vet. T3, het actieve schildklierhormoon, wordt opgenomen door de bruine vetcel en verplaatst zich dan naar de celkern, waar het bindt aan de promotor van het UCP-1-gen.7 Dit leidt tot verhoogde transcriptie van het gen, toename van UCP-1-eiwit en dientengevolge tot een verhoogde omzetting van triglyceriden en glucose waarbij warmte wordt geproduceerd.6 Verder is T3 in staat tot stabilisatie van het UCP-1-mRNA, waardoor afbraak ervan in de cel wordt verminderd.6 Tijdens koude-inductie is de activiteit van het enzym type 2-deiodinase (D2) in bruin vet verhoogd, wat leidt tot lokaal verhoogde concentraties T3. Ook dit mechanisme is noodzakelijk om thermogenese door bruin vet te stimuleren.
Bruin vet bij volwassenen
De primaire functie van bruin vet is het produceren van warmte (‘non-shivering thermogenesis’) om een daling van de lichaamstemperatuur tegen te gaan. Bij neonaten in het bijzonder is dit een belangrijk mechanisme, omdat neonaten een relatief groot lichaamsoppervlak hebben terwijl hun rilcapaciteit gering is door onderontwikkeling van de spieren.6
Bij knaagdieren en andere zoogdieren blijft het bruine vet doorgaans in grote hoeveelheden aanwezig gedurende het leven, maar bij mensen neemt de hoeveelheid bruin vet snel af na de peutertijd. Tot voor kort werd zelfs aangenomen dat volwassenen vrijwel geen bruin vet hebben; het is immers nauwelijks meer noodzakelijk omdat in de volwassenheid voornamelijk spieren bijdragen aan de warmteproductie. Recent werd echter bij volwassenen die in de winter een FDG-PET-CT-scan ondergingen om maligniteiten in beeld te brengen, glucoseopname gevonden in locaties die overeenkwamen met die van bruin vetweefsel. Bruine vetcellen nemen door hun hoge metabolisme net als maligne cellen in verhoogde mate glucose op. Biopten uit deze gebieden toonden inderdaad een zeer hoge expressie van UCP-1, de unieke marker voor bruin vet.
Verder onderzoek met FDG-PET-CT-scans laat zien dat – na koude-inductie – bruin vet bij nagenoeg 100% van de jongvolwassenen aanwezig is (figuur 3).2 Recente genotypering van humane bruin-vetbiopten laat echter zien dat dit vet meer overeenkomt met het beige vet dat in witte vetdepots bij muizen wordt gevonden dan met het klassieke bruine vet.8 Of beige vet bij mensen dezelfde fysiologische eigenschappen heeft als het klassieke bruine vet bij muizen, zal de komende jaren moeten blijken.

Betrokkenheid bruin vet bij afwijkingen
Hibernomen en feochromocytomen
Er zijn 2 klinische condities bij volwassenen waarbij de aanwezigheid van bruin vet al eerder was opgemerkt: hibernomen en feochromocytomen. Hibernomen zijn zeldzame, goedaardige tumoren, die hun naam danken aan de gelijkenis met bruin vetweefsel in dieren die in winterslaap (hibernatie) gaan. Ze zijn duidelijk zichtbaar op FDG-PET-CT-scans, wat aangeeft dat de tumor metabool actief is.9 Feochromocytomen zijn neuro-endocriene tumoren die in overmaat noradrenaline secerneren. Noradrenaline is een belangrijke activator van bruin vet. Op FDG-PET-CT-scans bij patiënten met deze tumor is inderdaad een verhoogde massa en activiteit van bruin vet te zien. Bovendien neemt na resectie van de tumor de FDG-opname drastisch af. De verhoogde activiteit van bruin vet draagt waarschijnlijk sterk bij aan de verhoogde stofwisselingssnelheid die kenmerkend is voor deze aandoening.10
Hyperthyreoïdie en hypothyreoïdie
Bij mensen met hyperthyreoïdie is het energiegebruik verhoogd, terwijl dit bij hypothyreoïdie verlaagd is. Bij muizen is aangetoond dat schildklierhormoon zowel direct – via de T3-receptor – als indirect – via het sympathische zenuwstelsel – betrokken is bij de activatie van bruin vet.11,12 Het gewichtsverlies en het zweten bij patiënten met hyperthyreoïdie, en de gewichtstoename en verminderde koudetolerantie bij patiënten met hypothyreoïdie kunnen daarom op een verhoogde respectievelijk verlaagde activiteit van bruin vet berusten.6
Obesitas en diabetes mellitus type 2
Interessant is de bevinding dat de hoeveelheid bruin vet bij volwassenen omgekeerd evenredig is met de BMI en het lichaamsvetpercentage.2 Nauwkeuriger gezegd: het volume en de activiteit van bruin vet zijn omgekeerd evenredig met parameters voor centrale obesitas, zoals het visceraal-vetvolume op de CT-scan en de middelomtrek.10 Deze bevindingen suggereren dat obesitas verband houdt met een lagere activiteit van het bruine vet.
Enerzijds zou de lagere activiteit kunnen predisponeren tot obesitas en obesitas-gerelateerde aandoeningen als diabetes mellitus type 2 (DM2), door ophoping van triglyceriden in het bloed en dientengevolge opslag in de vorm van wit vet. Die opslag kan onder meer plaatsvinden in ectopische vetdepots zoals spier- en leverweefsel. Inderdaad is bij muizen aangetoond dat excisie van bruin vet leidt tot hypertriglyceridemie en obesitas.13
Anderzijds zou isolatie door de dikke subcutane witte vetlaag bij obese personen voldoende effectief kunnen zijn voor het handhaven van de lichaamstemperatuur. Actief bruin vet is in dat geval overbodig; de lage activiteit van bruin vet zou dan een gevolg van obesitas zijn.14
Bruin vet verbrandt zowel triglyceriden als glucose. Bruin vet zou daarom ook kunnen bijdragen aan de glucosehomeostase, vooral bij minimaal glucoseverbruik door spieren in rust. Een lage activiteit van bruin vet zou dus niet alleen kunnen predisponeren tot DM2 via het genoemde verband met obesitas, maar ook via een verminderde glucoseopname in rust.15
Beïnvloeding volume en activiteit van bruin vet
Bovenstaande bevindingen maken duidelijk dat het verhogen van het volume en de activiteit van bruin vet een veelbelovend aangrijpingspunt is voor een verhoging van het totale energiegebruik. Daarmee is mogelijk gewichtsverlies te induceren. Theoretisch kunnen het volume en de activiteit van bruin vet op verschillende manieren verhoogd worden. Daarbij wordt onderscheid gemaakt tussen methoden die het al aanwezige bruine vet activeren en methoden die het rekruteren van nieuw bruin vet stimuleren.
Activatie van aanwezig bruin vet
Bruin vet wordt sterk geïnnerveerd door het sympathische zenuwstelsel (zie figuur 2). Dat biedt aangrijpingspunten voor mogelijke interventies. Ook het fenomeen van ontkoppeling vormt een aangrijpingspunt.
Kou De belangrijkste activator van bruin vet via het sympathische zenuwstelsel is kou. Meerdere studies hebben een relatie aangetoond tussen het volume en de activiteit van bruin vet en de buitentemperatuur, met de hoogste activiteit tijdens de koudste maand van het jaar.16 De simpelste methode om bruin vet te activeren lijkt daarom koude-inductie, bijvoorbeeld via het creëren van een koudere woon- of werkomgeving. Of dit daadwerkelijk effect zal hebben op bruin vet en op die manier gewichtsverlies kan induceren, moet nog onderzocht worden.
Sympathicomimetica Naast indirecte activatie van β3-adrenerge receptoren door kou zouden ook sympathicomimetica gebruikt kunnen worden. In muismodellen leken deze zeer succesvol te zijn.17 Helaas bleef het verwachte gewichtsreducerende effect bij mensen uit; bovendien was sprake van – soms levensbedreigende – bijwerkingen.18,19 Vooralsnog worden deze middelen dan ook niet voor deze klinische doeleinden gebruikt.
Ontkoppelaars Het verhogen van de ontkoppeling van ATP-synthese naar warmteproductie in bruin vetweefsel of andere weefsels, zoals wit vet of spier (bij ectopische expressie), zou een effectieve methode zijn om het energiegebruik te verhogen. Al in de jaren 30 van de vorige eeuw werd de chemische ontkoppelaar 2,4-dinitrofenol (DNP) met succes gebruikt als ingrediënt in dieetpillen. Chemische ontkoppelaars werken echter in op de oxidatieve processen in alle weefsels, en niet specifiek op één of meerdere weefsels. Wegens ernstige bijwerkingen als hyperthermie werd dit middel dan ook in 1938 van de markt gehaald.20 Het huidige onderzoek richt zich op het verhogen van – al dan niet ectopische – expressie van natuurlijk voorkomende ontkoppelaars, zoals UCP-1.21,22
Rekrutering van nieuw bruin vet
Nieuw bruin vet zou gerekruteerd kunnen worden door de differentiatie van voorlopercellen of van witte vetcellen tot bruine vetcellen te stimuleren.
PPAR-γ-agonisten Een van de belangrijke regulatoren in de differentiatie van vetcellen is PPAR-γ. In dierstudies is aangetoond dat PPAR-γ-agonisten voorlopercellen van bruin vet kunnen rekruteren en bovendien ook witte vetcellen kunnen ‘bruinen’, zodat ze UCP-1 verkrijgen.23 PPAR-γ-agonisten worden in de praktijk al toegepast bij de behandeling van DM2: de thiazolinedionen (TZD’s). Onderzoek heeft laten zien dat de verbetering in insulinesensitiviteit bij TZD’s mede veroorzaakt wordt door een versnelde glucoseklaring in bruin vet.24 Opvallend is echter dat gebruik van TZD’s leidt tot gewichtstoename – deels te wijten aan vochtretentie – en een andere vetverdeling. Daardoor ligt hun gebruik als vermageringsmiddel niet voor de hand. Bovendien worden deze middelen nog maar beperkt voorgeschreven in verband met bijwerkingen als hartfalen en osteoporotische fracturen.
BMP-7 Een andere belangrijke regulator van de differentiatie tot bruine vetcel is BMP-7. Recent onderzoek bij muizen heeft aangetoond dat BMP-7 een effectief middel is om de hoeveelheid bruin vet – zowel in de vetkussentjes als perifeer – te vergroten. Dit leidt tot een toename van het energiegebruik en daarmee tot gewichtsverlies (Boon et al., ongepubliceerde data).3,25
Irisine Irisine is een recent ontdekt hormoon dat zowel bij muizen als mensen door skeletspieren wordt gesecerneerd tijdens inspanning. In een studie bij muizen is onlangs aangetoond dat exogene toediening van irisine het ‘bruinen’ van subcutaan wit vet induceert. Dit resulteerde in toename in energiegebruik, afname in gewicht en verbetering in glucosetolerantie.26
Conclusie
Bruin vet produceert warmte door de verbranding van triglyceriden en glucose via het ontkoppelingseiwit UCP-1 los te koppelen van ATP synthese. Daarmee heeft bruin wetweefsel een aanzienlijk aandeel in het totale energiegebruik. De recente observatie dat volwassenen actief bruin vet hebben, biedt daarom wellicht nieuwe mogelijkheden in de strijd tegen overgewicht. Momenteel wordt veel onderzoek gedaan naar het activeren van bruin vet als behandelstrategie voor obesitas. In muismodellen lijken we dicht bij dat doel te zijn. De komende jaren zullen moeten uitwijzen of bruin vet ook bij mensen het doelorgaan kan worden om obesitas en gerelateerde aandoeningen als diabetes mellitus type 2 aan te pakken.
Leerpunten
-
Bruin vet verbrandt triglyceriden en zet de energie om in warmte.
-
Bij neonaten is de activiteit van bruin vet belangrijk voor het handhaven van de lichaamstemperatuur.
-
Sinds kort weten we dat ook bij volwassenen bruin vet aanwezig en actief is.
-
Het volume en de activiteit van bruin vet bij volwassen zijn omgekeerd evenredig met de BMI en het vetpercentage.
-
Aandoeningen die de activiteit van bruin vet verhogen, zoals hyperthyreoïdie en feochromocytomen, leiden tot gewichtsverlies en warmteontwikkeling.
-
Het verhogen van de activiteit van bruin vet wordt beschouwd als een veelbelovende strategie om het energiegebruik te verhogen en daarmee gewichtsverlies te induceren.
Literatuur
-
Jazet IM, Pijl H, Meinders AE. Adipose tissue as an endocrine organ: impact on insulin resistance. Neth J Med. 2003;61:194-212 Medline.
-
Van Marken Lichtenbelt WD, Vanhommerig JW, Smulders NM, et al. Cold-activated brown adipose tissue in healthy men. N Engl J Med. 2009;360:1500-8 Medline. doi:10.1056/NEJMoa0808718
-
Boon MR, van der Horst G, van der Pluijm G, Tamsma JT, Smit JW, Rensen PC. Bone morphogenetic protein 7: a broad-spectrum growth factor with multiple target therapeutic potency. Cytokine Growth Factor Rev. 2011;22:221-9 Medline. doi:10.1016/j.cytogfr.2011.08.001
-
Frühbeck G, Becerril S, Sainz N, Garrastachu P, Garcia-Velloso MJ. BAT: a new target for human obesity? Trends Pharmacol Sci. 2009;30:387-96 Medline. doi:10.1016/j.tips.2009.05.003
-
Celi FS. Brown adipose tissue--when it pays to be inefficient. N Engl J Med. 2009;360:1553-6.Medline
-
Cannon B, Nedergaard J. Brown adipose tissue: function and physiological significance. Physiol Rev. 2004;84:277-359 Medline. doi:10.1152/physrev.00015.2003
-
Rabelo R, Reyes C, Schifman A, Silva JE. Interactions among receptors, thyroid hormone response elements, and ligands in the regulation of the rat uncoupling protein gene expression by thyroid hormone. Endocrinology. 1996;137:3478-87 Medline. doi:10.1210/en.137.8.3478
-
Wu J, Bostrom P, Sparks LM, et al. Beige adipocytes are a distinct type of thermogenic fat cell in mouse and human. Cell. 2012;150:366-76 Medline. doi:10.1016/j.cell.2012.05.016
-
Tsuchiya T, Osanai T, Ishikawa A, Kato N, Watanabe Y, Ogino T. Hibernomas show intense accumulation of FDG positron emission tomography. J Comput Assist Tomogr. 2006;30:333-6 Medline. doi:10.1097/00004728-200603000-00033
-
Wang Q, Zhang M, Ning G, et al. Brown adipose tissue in humans is activated by elevated plasma catecholamines levels and is inversely related to central obesity. PLoS ONE. 2011;6:e21006 Medline. doi:10.1371/journal.pone.0021006
-
Branco M, Ribeiro M, Negrao N, Bianco AC. 3,5,3’-Triiodothyronine actively stimulates UCP in brown fat under minimal sympathetic activity. Am J Physiol. 1999;276:E179-87 Medline.
-
López M, Varela L, Vazquez MJ, et al. Hypothalamic AMPK and fatty acid metabolism mediate thyroid regulation of energy balance. Nat Med. 2010;16:1001-8 Medline. doi:10.1038/nm.2207
-
Dulloo AG, Miller DS. Energy balance following sympathetic denervation of brown adipose tissue. Can J Physiol Pharmacol. 1984;62:235-40 Medline. doi:10.1139/y84-035
-
Vijgen GH, Bouvy ND, Teule GJ, et al. Increase in brown adipose tissue activity after weight loss in morbidly obese subjects. J Clin Endocrinol Metab. 2012;97:E1229-33.Medline doi:10.1210/jc.2012-1289
-
Nedergaard J, Cannon B. The changed metabolic world with human brown adipose tissue: therapeutic visions. Cell Metab. 2010;11:268-72 Medline. doi:10.1016/j.cmet.2010.03.007
-
Saito M, Okamatsu-Ogura Y, Matsushita M, et al. High incidence of metabolically active brown adipose tissue in healthy adult humans: effects of cold exposure and adiposity. Diabetes. 2009;58:1526-31 Medline. doi:10.2337/db09-0530
-
Subramanian S, Vollmer RR. Sympathetic activation by fenfluramine depletes brown adipose tissue norepinephrine content in rats. Pharmacol Biochem Behav. 2002;73:639-45 Medline. doi:10.1016/S0091-3057(02)00857-2
-
Vosselman MJ, van der Lans AAJJ, Brans B, Wierts R, van Baak MA, Schrauwen P, et al. Systemic β−Adrenergic stimulation of thermogenesis is not accompanied by brown adipose tissue activity in humans. Diabetes. 2012;61:3106-13.Medline
-
Haller CA, Benowitz NL. Adverse cardiovascular and central nervous system events associated with dietary supplements containing ephedra alkaloids. N Engl J Med. 2000;343:1833-8 Medline. doi:10.1056/NEJM200012213432502
-
Harper JA, Dickinson K, Brand MD. Mitochondrial uncoupling as a target for drug development for the treatment of obesity. Obes Rev. 2001;2:255-65 Medline. doi:10.1046/j.1467-789X.2001.00043.x
-
Couplan E, Gelly C, Goubern M, et al. High level of uncoupling protein 1 expression in muscle of transgenic mice selectively affects muscles at rest and decreases their IIb fiber content. J Biol Chem. 2002;277:43079-88 Medline. doi:10.1074/jbc.M206726200
-
Kopecký J, Rossmeisl M, Hodny Z, Syrovy I, Horakova M, Kolarova P. Reduction of dietary obesity in aP2-Ucp transgenic mice: mechanism and adipose tissue morphology. Am J Physiol. 1996;270:E776-86 Medline.
-
Petrovic N, Shabalina IG, Timmons JA, Cannon B, Nedergaard J. Thermogenically competent nonadrenergic recruitment in brown preadipocytes by a PPARgamma agonist. Am J Physiol Endocrinol Metab. 2008;295:E287-96 Medline. doi:10.1152/ajpendo.00035.2008
-
Teruel T, Hernandez R, Rial E, Martin-Hidalgo A, Lorenzo M. Rosiglitazone up-regulates lipoprotein lipase, hormone-sensitive lipase and uncoupling protein-1, and down-regulates insulin-induced fatty acid synthase gene expression in brown adipocytes of Wistar rats. Diabetologia. 2005;48:1180-8 Medline. doi:10.1007/s00125-005-1744-0
-
Schulz TJ, Huang TL, Tran TT, et al. Identification of inducible brown adipocyte progenitors residing in skeletal muscle and white fat. Proc Natl Acad Sci USA. 2011;108:143-8 Medline. doi:10.1073/pnas.1010929108
-
Boström P, Wu J, Jedrychowski MP, et al. A PGC1-alpha-dependent myokine that drives brown-fat-like development of white fat and thermogenesis. Nature. 2012;481:463-8 Medline. doi:10.1038/nature10777




Reacties