Licht wordt al heel lang toegepast in geneeskundige behandelingen, soms in combinatie met bepaalde stoffen uit planten. Die toepassing wordt steeds verfijnder. Er zijn zelfs geneesmiddelen die met licht ‘aan- en uitgeschakeld’ kunnen worden. Hoe werkt dat? En wat zijn de vooruitzichten?
Samenvatting
Al duizenden jaren maakt de mens gebruik van zichtbaar licht voor medische toepassingen. Tegenwoordig wordt licht klinisch gebruikt voor intraoperatieve beeldvorming en fotodynamische therapie. De precisie waarmee licht toegediend kan worden, maakt in potentie veilige en gerichte farmacologische behandelingen mogelijk. Dat is de drijfveer achter het opkomende gebied van de fotofarmacologie, die geneesmiddelen ontwikkelt waarvan de activiteit kan worden gereguleerd door bestraling met licht. Fotofarmacologische geneesmiddelen kunnen op twee manieren worden ontworpen. Ten eerste kan een geneesmiddel worden gedeactiveerd door er een groep aan te koppelen die met licht weer kan worden verwijderd. Ten tweede kan een moleculaire fotoschakelaar in een geneesmiddelmolecuul worden ingebouwd, zodat het met verschillende kleuren licht kan worden aan- en uitgeschakeld. In dit artikel geven we een overzicht van de basisprincipes en de toekomst van de fotofarmacologie, op weg naar klinische toepassingen.
artikel
Sinds de oudheid gebruikt de mensheid licht om ziekten te genezen. Een voorbeeld hiervan is in het oude Egypte te vinden. Naar verluidt vermeldt de Ebers-Papyrus de behandeling van huidziekten onder zonlicht. Ook is bekend dat de Egyptenaren groot akkerscherm (Ammi majus) gebruikten, een plant die psoraleen bevat.1 Een ander voorbeeld komt uit de hindoeïstische Atharvaveda, waar in een van de hymnen staat dat licht samen met de plant Psoralea corylifolia wordt gebruikt om lepra te behandelen.1
Ook vandaag de dag passen we licht toe in medische behandelingen. Een voorbeeld hiervan is de behandeling van hyperbilirubinemie met fototherapie. Tijdens deze behandeling wordt een neonaat in blauw licht gelegd om de toxische vorm van bilirubine om te zetten naar een wateroplosbare vorm, die vervolgens via de ontlasting en urine het lichaam verlaat.2
Wat maakt licht zo aantrekkelijk als hulpmiddel bij medische behandelingen? Ten eerste is de toepassing goed controleerbaar.3 Door de recente ontwikkelingen in laser- en led-technologie kunnen we licht toedienen met een ongekende controle over waar, wanneer, hoe lang en met welke intensiteit we dat doen. Ten tweede heeft zichtbaar licht zelf geen invloed op de menselijke fysiologie, wat betekent dat de behandeling veilig en selectief is. Maar hoe zien medische behandelingen met licht eruit op moleculair niveau?
Het gebruik van licht in de geneeskunde
Inmiddels begrijpen we hoe de hiervoor genoemde planten onder invloed van zonlicht werkzaam zijn. We kunnen deze kennis gebruiken om kunstmatige systemen te ontwerpen die licht omzetten in een genezend effect. Dit kan door middel van een molecuul dat zowel fotoactief als bioactief is. Fotoactieve moleculen absorberen de lichtenergie van fotonen en komen hierdoor in een hogere energetische toestand (zie het infokader). Vanuit deze toestand keren zij zo snel mogelijk terug naar de grondtoestand, waarbij de energie die vrijkomt op verschillende manieren kan worden gebruikt in de kliniek.4
Neem bijvoorbeeld het molecuul psoraleen, dat aanwezig is in groot akkerscherm. Psoraleenmoleculen die zijn aangeslagen door licht, dragen de energie over aan zuurstofmoleculen in hun omgeving om terug te kunnen keren naar hun grondtoestand. Dit resulteert in de vorming van zeer reactieve zuurstofcomponenten, die plaatselijk alles op hun pad wegbranden. Dit is het principe achter fotodynamische therapie, waarbij licht wordt gebruikt om plaatselijk moleculen te prikkelen om tumorcellen of infecties uit te roeien.5 Voorbeelden hiervan zijn de behandeling van onder meer blaaskanker, slokdarmkanker en periodontitis.1,6,7
Een ander proces waarmee een door licht geëxciteerd molecuul energie kan vrijmaken om terug te keren naar de grondtoestand, is de emissie van een foton. Dit proces staat bekend als fluorescentie. Aangezien een deel van de geabsorbeerde energie in de aangeslagen toestand verloren gaat, zal een uitgezonden foton een iets lagere energie hebben, dat wil zeggen: zijn kleur zal verschuiven naar de rode kant van de regenboog ten opzichte van het geabsorbeerde foton. Dit verschil staat bekend als de Stokes-verschuiving. Dit is zeer nuttig, want het stelt ons in staat om met fluorescentiecamera’s fluorescerende moleculen in beeld te brengen. Dat vormt de basis voor optische beeldvorming waarbij bijvoorbeeld uitzaaiingen tijdens operaties worden gemarkeerd met fluorescerende moleculen.8
Maar als we licht gebruiken om een ziekte te lokaliseren, kunnen we het dan ook gebruiken om een behandeling op een bepaalde plaats te activeren, zodat we bijwerkingen in de rest van het lichaam vermijden? Het opkomende gebied van de fotofarmacologie zou het antwoord op deze uitdaging kunnen zijn.9
De activiteit van geneesmiddelen met licht reguleren
Fotofarmacologie is gebaseerd op nog weer andere processen die een molecuul kan doorlopen wanneer het uit de aangeslagen toestand komt. Deze processen, gezamenlijk bekend als fotochemie, berusten op een chemische reactie van het molecuul: het maken, verbreken of veranderen van chemische bindingen tussen atomen. Dankzij deze reacties kunnen wij licht gebruiken om geneesmiddelen plaatselijk te activeren. Dit is pure farmacologische activatie naar een krachtiger medicijn zonder de formatie van niet-selectieve, toxische zuurstofcomponenten zoals in het voorbeeld van psoraleen. Er zijn twee algemene manieren van fotofarmacologie: omkeerbare en onomkeerbare fotofarmacologie (figuur 1).
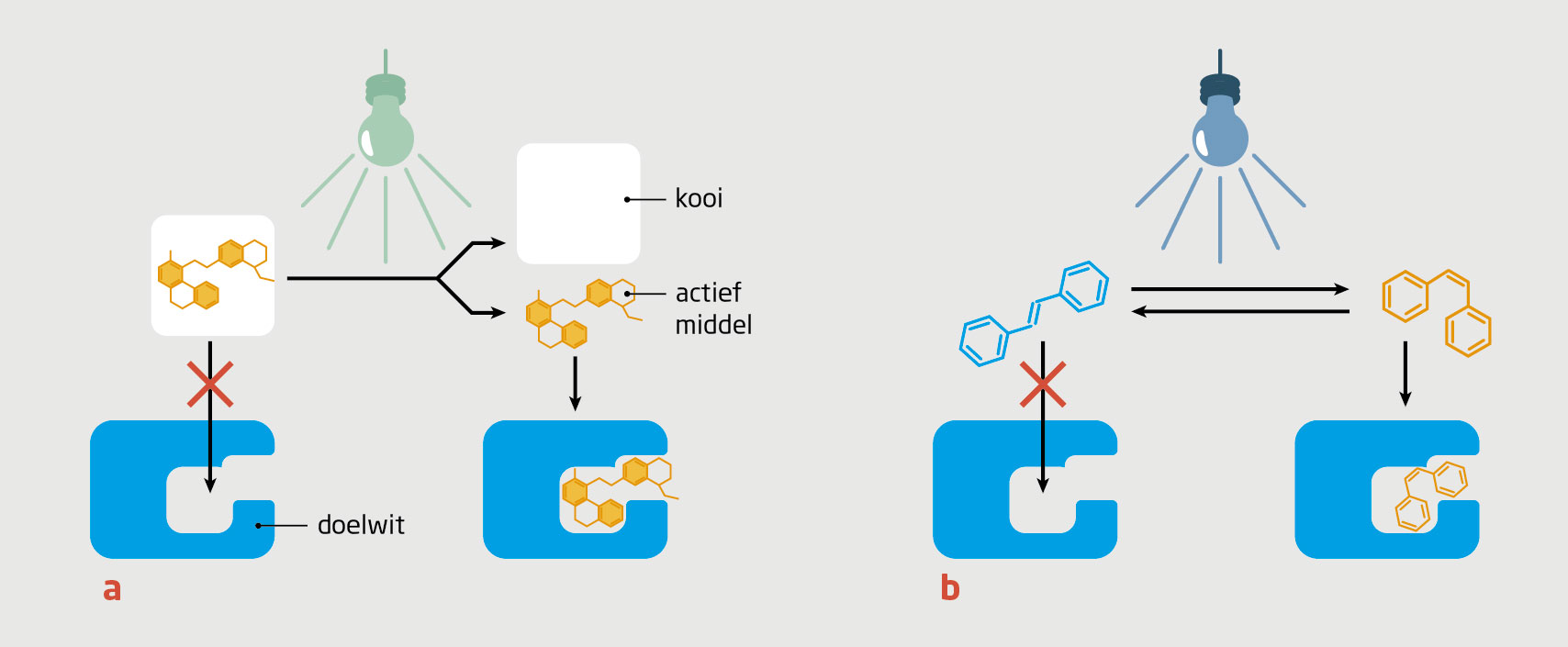
Onomkeerbare fotofarmacologie
Bij onomkeerbare fotofarmacologie wordt een bestaand geneesmiddel gewijzigd door er een groep aan te koppelen die reageert op licht, een zogenoemde ‘fotokooi’. Door de fotokooi is het geneesmiddel inactief.10 Bij de bestraling met licht breekt de binding tussen het geneesmiddel en de fotokooi, en komt de farmacologisch actieve stof vrij (zie figuur 1). Dit proces verloopt slechts in één richting, dat wil zeggen: wanneer de binding verbroken is, kan de fotokooi het geneesmiddel niet meer deactiveren.
Nadat de fotokooi is verwijderd, kan het actieve geneesmiddel zich vrij over het lichaam van de patiënt verspreiden. Dit kan resulteren in bijwerkingen, bijvoorbeeld als het een erg toxisch cytostaticum betreft. Dat beperkt de precisie van de behandeling. Toch is de onomkeerbare aanpak vaak de eerste keuze bij het ontwerpen van licht-responsieve geneesmiddelen, omdat hiermee grote verschillen in biologische activiteit kunnen worden bereikt tussen het gedeactiveerde en het vrije geneesmiddel.
Omkeerbare fotofarmacologie
In de omkeerbare fotofarmacologie wordt ernaar gestreefd de activering omkeerbaar te maken, zodat het geneesmiddel op commando kan worden aangeschakeld of uitgeschakeld.9 Om dit te bereiken worden er andere chemische hulpmiddelen gebruikt, namelijk moleculaire fotoschakelaars (‘fotoswitch’). Deze moleculen hebben twee vormen, ‘cis’ en ‘trans’ genaamd, die van elkaar verschillen in eigenschappen. Door bestraling met licht van verschillende kleuren kan worden geschakeld tussen deze twee vormen. Meestal is een van die vormen ook thermisch instabiel, en schakelt het molecuul na verloop van tijd weer terug naar de thermisch stabiele vorm. Met ‘moleculaire engineering’ krijgen chemici steeds meer greep op de kleuren van het licht die voor het omschakelen kunnen worden gebruikt en op de levensduur van de instabiele vorm.
Het meest uitdagende deel van een fotofarmacologisch geneesmiddelontwerp is de integratie van de moleculaire fotoschakelaar in de structuur van het geneesmiddelmolecuul, zodanig dat de thermisch instabiele vorm een veel hogere biologische activiteit vertoont dan de stabiele vorm. Als dit eenmaal is bereikt, kan men de biologische activiteit echt lokaal reguleren. Het geneesmiddel wordt dan onder bestraling ingeschakeld en wordt vervolgens uitgeschakeld wanneer het de lichtstraal verlaat.
Mogelijke toepassingen
Fotofarmacologie zal haar volle potentie laten zien in toepassingen waarbij de activiteit van een geneesmiddel nauwkeurig in tijd en positie moet worden gecontroleerd. In dit verband kunnen twee hoofdindicaties voor omkeerbare fotofarmacologische behandelingen worden onderscheiden: behandeling van kanker en behandeling van bacteriële infecties.
Behandeling van kanker
Bij de behandeling van kanker kan met behulp van fotofarmacologie lokale activering van cytostatica mogelijk gemaakt worden, waardoor de rest van het lichaam wordt beschermd tegen ernstige bijwerkingen van de behandeling. Op dit moment bestaan er al kankermedicijnen die fotoschakelbaar gemaakt zijn, waaronder de histondeacetylase(HDAC)-remmer belinostat,11 de dihydrofolaatreductase(DHFR)-remmer methotrexaat,12 en de tubulinepolymerisatieremmer combretastatine A-4.13
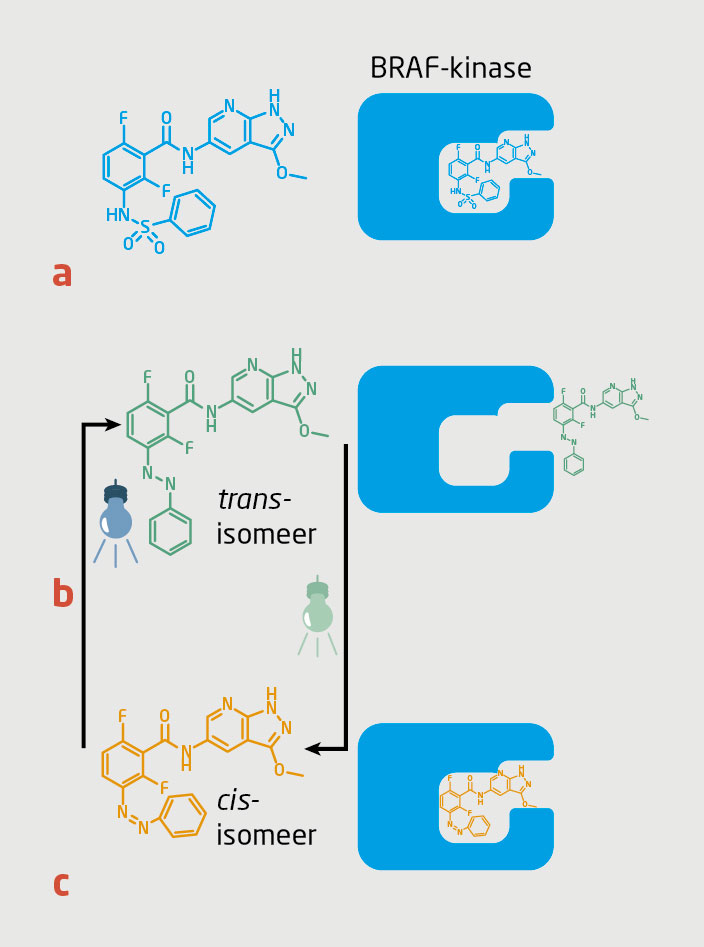
Het ontwerp van een fotoschakelbaar chemotherapeuticum kan worden geïllustreerd met de lichtgestuurde BRAF V600E-kinaseremmer in figuur 2, geïnspireerd op de structuur van geneesmiddelen als vemurafenib en dabrafenib.14 De originele enzymremmer past goed in het actieve centrum van het enzym en remt de activiteit (figuur 2a). De reversibel activeerbare enzymremmer is zo ontworpen dat de trans-isomeer niet goed past in het actieve centrum van het enzym (figuur 2b), maar de cis-isomeer wél (figuur 2c). Wanneer de inactieve trans-isomeer met licht van een specifieke golflengte bestraald wordt, gaat deze vorm over in de cis-isomeer, die net zo goed in het enzym past als de originele enzymremmer.
Een lokaal geactiveerd molecuul kan na activatie vrij door het lichaam bewegen. Zoals gezegd kan dit leiden tot bijwerkingen. Daarom is het lichtgestuurde molecuul in figuur 2 zo ontworpen dat het ook kan terugkeren naar de niet-actieve trans-vorm door bestraling met licht van een andere golflengte dan waarmee het geactiveerd wordt.
Behandeling van bacteriële infecties
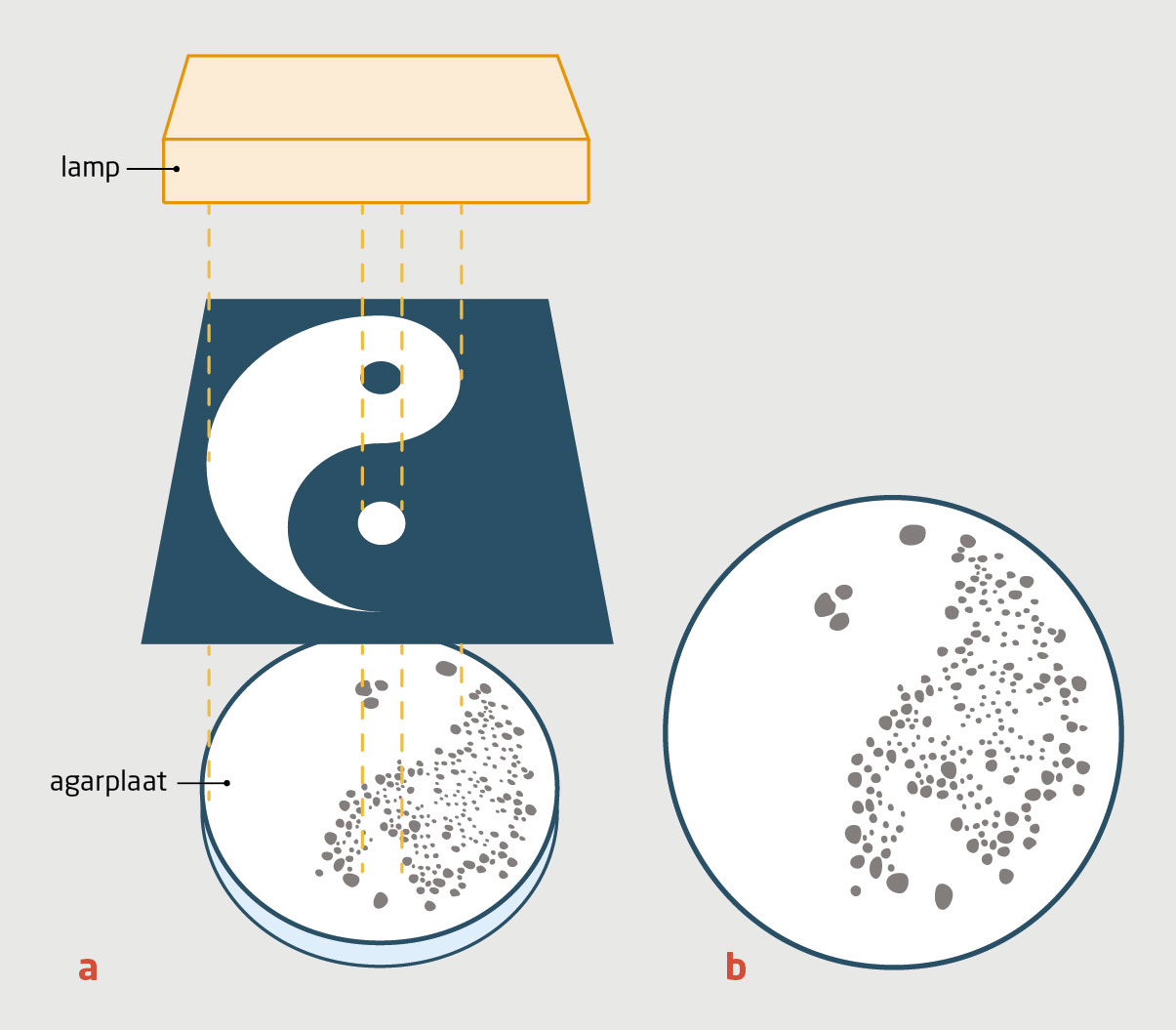
Het tweede gebied waarop fotofarmacologie van invloed kan zijn, is de behandeling van bacteriële infecties met antibiotica. Er is een toename van de resistentie tegen antibiotica door het overmatig gebruik ervan in de geneeskunde en de veehouderij. Wanneer antibiotica in het milieu komen, zetten zij bacteriën onder evolutionaire druk om resistentie te ontwikkelen en te verspreiden.15 Een niet voor de hand liggende aanpak van dit probleem zou zijn om antibiotica te produceren die inactief zijn en pas na bestraling met licht gedurende een beperkte tijd bacteriedodend werken.
Dit idee is verwezenlijkt met een fotoschakelbaar antibioticum (figuur 3),16 dat gebaseerd is op de chinolonen; voorbeelden uit deze groep zijn ciprofloxacine en ofloxacine. In de thermisch stabiele toestand vertoont de trans-isomeer van dit antibioticum een zeer geringe antibiotische activiteit. Onder bestraling met UV-licht schakelt het over naar de krachtigere cis-vorm, die enkele uren bestaat voordat het uit zichzelf terugkeert naar de trans-toestand. Dit geneesmiddel moet worden gebruikt onmiddellijk nadat het is geactiveerd; tegen de tijd dat het aan de omgeving wordt afgegeven, heeft het zijn kracht verloren.
Uitdaging
De belangrijkste uitdaging voor de toepassing van fotofarmacologie is de penetratie van het licht in het menselijk lichaam. Zelfs met het diepst doordringende nabij-infrarode licht kunnen we slechts 1-2 cm diep in zachte weefsels doordringen. Met dit in gedachten hebben wij in het verleden samen met chirurgen vijf klassen van organen in het menselijk lichaam gedefinieerd, gerangschikt naar de mate van ingrijpen die vereist is voor de fotofarmacologische behandeling (tabel).17,18 Wij verwachten dat fotofarmacologie haar eerste echte toepassing zal vinden in huidziekten en oogaandoeningen. Deze toepassingen zullen hopelijk de weg vrijmaken voor toepassingen dieper in het menselijke lichaam.
![Tabel | Bereikbaarheid van organen voor licht | Indeling in vijf klassen [5]](/uploads/2023-D7/44/D7444_T1.jpeg)
Vooruitzichten
Hoe ver is de fotofarmacologie van de kliniek verwijderd? In november 2022 werd de behandeling met een moleculaire fotoschakelaar voor het eerst toegepast bij de mens, bij een Australische patiënt met retinitis pigmentosa. Deze behandeling was bedoeld voor het herstel van het gezichtsvermogen en vond plaats in het kader van een fase I/II dosisescalatiestudie (ABACUS; clinical trial identifier: NCT05282953).
Hoewel veel vragen over de farmacokinetiek, toxiciteit en werkzaamheid van dit soort middelen nog onbeantwoord zijn, heeft de fotofarmacologie het potentieel om licht naar de kliniek te brengen en de manier waarop wij bepaalde ziekten behandelen, te veranderen. Natuurlijk blijft het een uitdaging om het licht in het menselijk lichaam te laten doordringen tot de plaatsen waar het nodig is, maar wij blijven zoeken naar nieuwe methoden. Zo zouden wij in plaats van licht toe te dienen, licht in het lichaam kunnen genereren. De methodes daarvoor kunnen gebaseerd zijn op chemoluminescentie, bioluminescentie, röntgenscintillatie of sonoluminescentie. Als een van deze methodes goed geoptimaliseerd is en licht inderdaad genereerd kan worden op de gewenste plek in het menselijk lichaam, komt de klinische toepassing van fotofarmacologie weer een stap dichterbij.
Literatuur
-
Abdel-Kader MH. The journey of PDT throughout history: PDT from Pharos to present. In: Kostron H, Hasan T (eds.). Photodynamic medicine: from bench to clinic. Cambridge: The Royal Society of Chemistry; 2016. pp. 1-21.
-
Anderson CM, Kandasamy Y, Kilcullen M. The efficacy of home phototherapy for physiological and non-physiological neonatal jaundice: A systematic review. J Neonatal Nurs. 2022;28:312-26. doi:10.1016/j.jnn.2021.08.010.
-
3.Yun SH, Kwok SJJ. Light in diagnosis, therapy and surgery. Nat Biomed Eng. 2017;1;0008. Medline
-
Welleman IM, Hoorens MWH, Feringa BL, Boersma HH, Szymański W. Photoresponsive molecular tools for emerging applications of light in medicine. Chem Sci (Camb). 2020;11:11672-91. doi:10.1039/D0SC04187D. Medline
-
Dolmans DEJGJ, Fukumura D, Jain RK. Photodynamic therapy for cancer. Nat Rev Cancer. 2003;3:380-7. doi:10.1038/nrc1071. Medline
-
Gunaydin G, Gedik ME, Ayan S. Photodynamic Therapy for the Treatment and Diagnosis of Cancer-A Review of the Current Clinical Status. Front Chem. 2021;9:686303. doi:10.3389/fchem.2021.686303. Medline
-
Bundidpun P, Srisuwantha R, Laosrisin N. Clinical effects of photodynamic therapy as an adjunct to full-mouth ultrasonic scaling and root planing in treatment of chronic periodontitis. Laser Ther. 2018;27:33-9. doi:10.5978/islsm.18-OR-03. Medline
-
Schouw HM, Huisman LA, Janssen YF, et al. Targeted optical fluorescence imaging: a meta-narrative review and future perspectives. Eur J Nucl Med Mol Imaging. 2021;48:4272-92. doi:10.1007/s00259-021-05504-y. Medline
-
Velema WA, Szymanski W, Feringa BL. Photopharmacology: beyond proof of principle. J Am Chem Soc. 2014;136:2178-91. doi:10.1021/ja413063e. Medline
-
Klán P, Šolomek T, Bochet CG, et al. Photoremovable protecting groups in chemistry and biology: Reaction mechanisms and efficacy. Chem Rev. 2013;113;119-91.
-
Szymanski W, Ourailidou ME, Velema WA, Dekker FJ, Feringa BL. Light-controlled histone deacetylase (HDAC) inhibitors: towards photopharmacological chemotherapy. Chemistry. 2015;21:16517-24. doi:10.1002/chem.201502809. Medline
-
Matera C, Gomila AMJ, Camarero N, Libergoli M, Soler C, Gorostiza P. Photoswitchable antimetabolite for targeted photoactivated chemotherapy. J Am Chem Soc. 2018;140:15764-73. doi:10.1021/jacs.8b08249. Medline
-
Borowiak M, Nahaboo W, Reynders M, et al. Photoswitchable inhibitors of microtubule dynamics optically control mitosis and cell death. Cell. 2015;162:403-11. doi:10.1016/j.cell.2015.06.049. Medline
-
Hoorens MWH, Ourailidou ME, Rodat T, et al. Light-controlled inhibition of BRAFV600E kinase. Eur J Med Chem. 2019;179:133-46. doi:10.1016/j.ejmech.2019.06.042. Medline
-
Martínez JL. Antibiotics and antibiotic resistance genes in natural environments. Science. 2008;321:365-7. doi:10.1126/science.1159483. Medline
-
Velema WA, van der Berg JP, Hansen MJ, Szymanski W, Driessen AJM, Feringa BL. Optical control of antibacterial activity. Nat Chem. 2013;5:924-8. doi:10.1038/nchem.1750. Medline
-
Lerch MM, Hansen MJ, van Dam GM, Szymanski W, Feringa BL. Emerging targets in photopharmacology. Angew Chem Int Ed Engl. 2016;55:10978-99. doi:10.1002/anie.201601931. Medline
-
Van Dam GM, Themelis G, Crane LMA, et al. Intraoperative tumor-specific fluorescence imaging in ovarian cancer by folate receptor-α targeting: first in-human results. Nat Med. 2011;17:1315-9. doi:10.1038/nm.2472. Medline




Reacties