De calciumhomeostase is een complex proces. Er zijn verschillende bepalingen die kunnen worden aangevraagd bij patiënten met een hypo- of hypercalciëmie, maar de interpretatie van de resultaten is niet altijd eenvoudig. In deze LabQuiz worden de klinisch-chemische differentiaaldiagnostiek en de achtergronden van de laboratoriumbepalingen uiteengezet.
Casus 1
Patiënt A, een 49-jarige vrouw wordt na een fractuur van de rechter pols als gevolg van een val verwezen naar de fractuur- en osteoporosepolikliniek voor aanvullende analyse. Patiënte heeft geen klachten, gebruikt geen medicatie en de tractusanamnese levert geen bijdragende gegevens op. Bij lichamelijk onderzoek zien wij een gezonde vrouw, in goede…
Artikelinformatie
Citeer dit artikel als
Antwoorden
Antwoord casus 1: b; hypercalciëmie door primaire hyperparathyreoïdie
Patiënt A, een 49-jarige vrouw werd na een traumatische fractuur van de rechter pols verwezen naar de fractuur- en osteoporosepolikliniek. Patiënte had geen klachten en de tractusanamnese was niet bijdragend. Haar gewicht was stabiel. De voorgeschiedenis vermeldde geen bijzonderheden, ze gebruikte geen medicatie. In de familie kwam schildklierziekte voor bij haar moeder en zus. De berekende calciuminname via de voeding bedroeg 1000 mg per 24 h (overeenkomstig de aanbevolen dagelijkse inname van calcium). Bij lichamelijk onderzoek zagen wij een gezonde vrouw; haar BMI bedroeg 27,8 kg/m2.
Laboratoriumonderzoek Bij laboratoriumonderzoek werd een hypercalciëmie vastgesteld. De concentratie totaal calcium was 3,36 mmol/l (referentiewaarde: 2,10-2,55), en de concentratie albumine was 42 g/l (35-50). De concentratie anorganisch fosfaat in het serum was verlaagd: 0,62 mmol/l (0,87-1,45). Gezien de sterke verhoging van het totaal calcium werd gedacht aan een laboratoriumfout. Bij herhaling van de bepaling was de concentratie calcium 3,28 mmol/l bij wederom een niet-afwijkende albumine-waarde. Ter nadere analyse werd het parathyreoïdaal hormoon (PTH) bepaald; de concentratie hiervan was duidelijk verhoogd: 32 pmol/l (referentiewaarde: 1,7-9,2).
Diagnose Differentiaaldiagnostisch moet bij deze bevindingen gedacht worden aan primaire hyperparathyreoïdie en familiaire hypocalciurische hypercalciëmie. Om onderscheid te maken tussen beide oorzaken werd de calciumuitscheiding in de 24-uursurine bepaald. Deze was niet-afwijkend: 5,9 mmol/24 h (referentiewaarde: 2,5-7,5). Hierop werd de diagnose ‘primaire hyperparathyreoïdie’ gesteld.
Aanvullend onderzoek Om afwijkingen van de bijschildklieren in beeld te brengen, werden een bijschildklier-scintigrafie en een echo van de hals verricht. De resultaten van beide onderzoeken lieten aanwijzingen zien voor een bijschildklieradenoom ter hoogte van de onderpool van de linker schildklierkwab. Patiënte werd geopereerd waarbij het adenoom geëxtirpeerd werd. Postoperatief volgde een snelle daling van PTH (tot 0,7 pmol/l) en de calciumconcentratie normaliseerde zonder een fase met hypocalciëmie. Vanwege de recente fractuur en omdat de disregulatie van PTH en calciumhuishouding waarschijnlijk al lang bestond, werd om de botdichtheid te bepalen een ‘dual-energy X-ray’-absorptiometrie(DEXA)-scan verricht. Deze toonde ernstige osteoporose, en daarom werd patiënte enige weken na de operatie ingesteld op behandeling met een bisfosfonaat.
Antwoord casus 2: b; hypocalciëmie door een vitamine D-deficiëntie
Patiënt B, een 65-jarige vrouw, werd verwezen naar de polikliniek Interne geneeskunde. Zij had al langer bestaande buikklachten en een wisselend defecatiepatroon met diarree. Tevens had ze al langer tintelingen in de vingers en spierkrampen. De voorgeschiedenis vermeldde een CVA van de rechter cerebrale hemisfeer. Als medicatie gebruikte zij acetylsalicylzuur 80 mg 1 dd, simvastatine 40 mg 1 dd en candesartan 16 mg 1 dd. In de familie kwamen geen bijzondere aandoeningen voor. Bij lichamelijk onderzoek maakte patiënte een licht anemische indruk, er waren geen aanwijzingen voor hyper- of hypothyreoidie. Patiënte woog 45 kg bij een lengte van 158 cm, haar BMI was 18 kg/m2. Er werden geen andere afwijkingen vastgesteld.
Aanvullend onderzoek Elders was aanvullend onderzoek verricht, bestaande uit echografie van de bovenbuik, colonoscopie en consultatie door een neuroloog. Dit leverde geen diagnose op. Bij laboratoriumonderzoek op onze polikliniek bleek sprake van een hypocalciëmie (referentiewaarden tussen haakjes) met een concentratie totaal calcium van 2,04 mmol/l (2,10-2,55), een niet-afwijkende concentratie anorganisch fosfaat (1,03 mmol/l (0,9-1,32)), een verhoogde waarde van het alkalische fosfatase (184 U/l (<140)) en een microcytaire anemie (Hb: 7,0 mmol/l (7,5-10,0); MCV: 80 fl (82-98)).
Wij dachten differentiaaldiagnostisch aan een vitamine D-deficiëntie, mogelijk in het kader van een malabsorptiesyndroom, een primaire hypoparathyreoïdie of een hypomagnesiëmie bij diarree. Verder onderzoek toonde een verhoogde concentratie van PTH (19 pmol/l; referentiewaarde: 1,7-9,2), een sterk verlaagde concentratie van 25-hydroxyvitamine D (< 10 nmol/l (50-125)), een verlaagde concentratie ferritine (5 µg/l (30-300)) en een sterk verlaagde calciumexcretie in de 24-uursurine (0,2 mmol/24 h (2,5-7,5)). De waarden voor magnesium, foliumzuur en vitamine B12 waren niet-afwijkend.
Diagnose Er werd een ernstige vitamine D-deficiëntie met secundaire hyperparathyreoïdie vastgesteld. Als gevolg hiervan was er een sterk verlaagde calciumexcretie in de urine en een verhoogde serumwaarde van het alkalische fosfatase, passend bij osteomalacie. Een botbiopsie om dit aan te tonen werd door patiënte geweigerd. Er werd gedacht aan een malabsorptie van vitamine D waarvoor een gastroduodenoscopie met duodenumbiopsie werd verricht. Het histopathologisch onderzoek van de biopten toonde een totale vlokatrofie (Marsh 3C volgens de classificatie van Marsh en Oberhuber, zie uitlegkader), wijzend op coeliakie. Tevens werd een DEXA-scan verricht, waarop een ernstig verlaagde botdichtheid werd gezien in zowel de lumbale wervelkolom als de linker heup (de ‘totale heup’ volgens de DEXA-scan). De botdichtheid wordt volgens de WHO-richtlijnen uitgedrukt in een T-score; de SD ten opzichte van een gezonde populatie. Een T-score van ≥ -1,0 SD is niet afwijkend; tussen -1,0 en -2,5 SD is er sprake van osteopenie en bij ≤ -2,5 SD is er osteoporose. Op de DEXA-scan van patiënte werden voor de lumbale wervelkolom respectievelijk de heup T-scores van -3,9 en -3,7 gevonden. Dit wees dus op een ernstige osteoporose. Patiënte werd behandeld met een glutenvrij dieet, vitamine D- en calciumsubstitutie en kortdurend ijzersuppletie. Nadat de waarden van zowel 25-hydroxyvitamine D en PTH genormaliseerd waren, werd zij aanvullend behandeld met een oraal bisfosfonaat.
Uitleg
Verdieping LabQuiz
Van alle mineralen in het menselijk lichaam komt calcium in de grootste hoeveelheden voor: 25.000 mmol – ofwel 1 kg – waarvan 99% opgeslagen ligt in de botten. De hoeveelheid calcium in de extracellulaire ruimte bedraagt slechts 22,5 mmol, waarvan 9 mmol in plasma. Bot is metabool gezien een ‘open’ weefsel, dat wil zeggen dat er continue uitwisseling van metabolieten is met omliggende weefsels. De uitwisseling van calcium tussen bot en extracellulaire ruimte is ongeveer 500 mmol/24 h. In de nieren wordt geïoniseerd calcium gefiltreerd (240 mmol/24 h) waarvan het merendeel gereabsorbeerd wordt in de tubuli. De normale renale calciumexcretie bedraagt 2,5-7,5 mmol/24 h. De minimale aanbevolen dagelijkse calciuminname via het dieet is 25 mmol (1 g) en een groot deel hiervan gaat via de faeces verloren.
Calcium is een belangrijk bestanddeel van botten en tanden. Daarnaast heeft calcium een groot effect op neuromusculaire activiteit, wat duidelijk herkenbaar is in de symptomatologie van hypo- en hypercalciëmie. Een verlaagde calciumconcentratie kan leiden tot neuromusculaire hyperexciteerbaarheid (tetanie, of tonische spierkrampen). Bij sterk verhoogde calciumconcentraties is het omgekeerde het geval: er kan dan sprake zijn van spierslapte en verminderde prikkelbaarheid. Verder is calcium een cofactor voor diverse enzymen, met name stollingsfactoren, en is het als boodschappermolecuul betrokken bij vele signaaltransductie-cascades.
Regulatie van extracellulaire calciumconcentratie
De extracellulaire calciumconcentratie wordt door het lichaam binnen nauwe grenzen gehouden, waarbij 2 belangrijke hormonen betrokken zijn: parathyreoïdaal hormoon (PTH) en 1,25-dihydroxyvitamine D.
Parathyreoïdaal hormoon PTH wordt geproduceerd door de bijschildklieren waar zich calciumgevoelige receptoren bevinden. Hypocalciëmie stimuleert de productie en afgifte van PTH, hypercalciëmie heeft het tegenovergestelde effect. PTH verhoogt de extracellulaire calciumconcentratie door (a) verhoogde ‘1-hydroxylering’ in de nieren, waardoor het actieve hormoon 1,25-dihydroxyvitamine D ontstaat, dat calciumabsorptie in de darm verhoogt; (b) stimulering van de tubulaire reabsorptie van calcium in de nieren, en (c) verhoogde botresorptie via activatie van osteoclasten. PTH remt daarnaast de tubulaire reabsorptie van anorganisch fosfaat en bicarbonaat in de nieren. PTH reguleert de fosfaatexcretie, maar veranderingen in de serumfosfaatconcentratie hebben geen directe invloed op de PTH-secretie. De productie en perifere werking van PTH is afhankelijk van magnesium; een ernstige hypomagnesiëmie leidt tot verminderde aanmaak van PTH en tegelijkertijd tot een PTH-resistentie van de nieren en het skelet.
1,25-dihydroxyvitamine D Het hormoon 1,25-dihydroxyvitamine D stimuleert de absorptie van calcium en fosfaat in de darmen en activeert osteoclasten, waardoor de botresorptie toeneemt. Botresorptie leidt tot een verhoging van de extracellulaire concentraties van calcium en anorganisch fosfaat. Daarnaast kan 1,25-dihydroxyvitamine D de productie van PTH remmen. Het hormoon 1,25-dihydroxyvitamine D wordt geproduceerd door opeenvolgende stappen van hydroxylering in de lever (‘25-hydroxylering’) en de nieren (‘1-hydroxylering’). De 1-hydroxylering wordt gestimuleerd door een stijging in PTH-concentratie en wordt geremd door een daling in de concentratie van anorganisch fosfaat.
Verschillende bepalingen en testeigenschappen
Symptomen die kunnen wijzen op een hypercalciëmie zijn lethargie, cognitieve achteruitgang, spierzwakte en ook polyurie en polydipsie. Symptomen van een hypocalciëmie zijn juist tetanie, spierkrampen, toegenomen prikkelbaarheid en een mogelijke vermindering van de nierfunctie. Door de nauwe samenhang tussen de calciumregulatie en botvorming of -afbraak kan er ook sprake zijn van botpijn of osteoporotische fracturen; dit wordt ‘remodelling’ genoemd. Bij aanwijzingen voor een hyper- of hypocalciëmie of tekenen van remodelling is het zinvol om eerst de concentratie totaal calcium in het serum te bepalen. De bepaling van de concentratie totaal calcium is ook geïndiceerd bij nierstenen en maligniteiten. Het is goed te bedenken dat klachten zich meestal pas ontwikkelen bij calciumconcentraties < 1,75 of > 3,00 mmol/l.
Indien de concentratie totaal calcium afwijkend is dienen ook de waarden van albumine, anorganisch fosfaat, PTH en 25-hydroxyvitamine D bepaald te worden. Ook de concentratie calcium in de 24-uursurine en de concentratie magnesium in het serum zijn van belang voor de differentiële diagnostiek bij respectievelijk hyper- en hypocalciëmie. De verschillende bepalingen, hun uitslagen en de relatie met de diagnostiek en oorzaken van een hypercalciëmie worden beschreven in tabel 2. Hetzelfde voor hypocalciëmie wordt weergegeven in tabel 3. Hieronder beschrijven wij per bepaling enkele belangrijke kenmerken.


Totaal calcium Calcium is voor circa 50% gebonden aan eiwitten, met name aan albumine. Alleen het ongebonden, geïoniseerde calcium is fysiologisch actief. Voor de routinelaboratoriumdiagnostiek is het voldoende om de concentratie totaal calcium in het serum te bepalen. Het verdient aanbeveling om te corrigeren voor een afwijkende albumineconcentratie – aangezien dit de hoeveelheid ongebonden calcium beïnvloedt – met de berekening weergegeven in het uitlegkader. De prevalentie van hypo-albuminemie is hoog en heeft als oorzaken bijvoorbeeld ondervoeding, malabsorptie, leverfalen, maligniteit en bij ernstige ziekte in het algemeen.
De specifieke bepaling van de concentratie geïoniseerd calcium is slechts geïndiceerd bij extreem afwijkende albumine-concentraties, zuur-basestoornissen (acidose, alkalose), massale bloedtransfusie en tijdens extracorporale circulatie. Het wordt niet aanbevolen om routinematig geïoniseerd calcium aan te vragen, omdat het bloed voor deze bepaling bij voorkeur binnen 1 h na afname gecentrifugeerd dient te worden. Dit past slecht binnen de logistiek van een regionale bloedafnamedienst. Bovendien kan de bepaling van geïoniseerd calcium alleen uitgevoerd worden met behulp van apparatuur waarmee tevens bloedgasanalyse plaatsvindt. De doorlooptijd van bloedgasanalyse – veelal een spoedanalyse – mag eigenlijk niet negatief beïnvloed worden door dit soort routinebepalingen. Daarnaast moet voor de bepaling van geïoniseerd calcium altijd een extra buis bloed afgenomen worden, terwijl laboratoria zich juist als doel hebben gesteld zo min mogelijk bloed bij patiënten af te nemen.
De concentratie totaal calcium kan foutief verhoogd zijn door een gestuwde bloedafname (pseudohypercalciëmie: dit ontstaat door waterverplaatsing naar de extravasale ruimte bij stuwing), in tegenstelling tot de concentratie geïoniseerd calcium. Een foutief verlaagde waarde kan het gevolg zijn van het gebruik van een onjuiste bloedbuis (bijvoorbeeld een EDTA- of citraatbuis in plaats van een stolbuis).
Anorganisch fosfaat Fosfaat is intracellulair vooral aanwezig als organisch fosfaat (fosfolipide, fosfoproteïne). Organisch fosfaat is het meest voorkomende intracellulaire anion. Extracellulair bestaat de hoeveelheid fosfaat echter voor 85% uit anorganisch fosfaat (de verhouding monowaterstoffosfaat (HPO4 2-) en diwaterstoffosfaat (H2PO4 -) is ongeveer 4:1). Zoals eerder genoemd remt anorganisch fosfaat de 1-hydroxylering en verlaagt het daarmee de concentratie 1,25-dihydroxyvitamine D. Tevens wordt de reabsorptie van anorganisch fosfaat in de nieren geremd door PTH. De bepaling van de concentratie anorganisch fosfaat kan dus extra informatie geven over de processen in de calciumhuishouding. Echter, veranderingen in de concentratie anorganisch fosfaat hebben geen directe invloed op de PTH-secretie.
Parathyreoïdaal hormoon PTH is een polypeptide bestaande uit 84 aminozuren. De biologische activiteit is gelegen in het N-terminale deel (aminozuren 1-34) van het eiwit. Het volledig intacte PTH-eiwit (iPTH) heeft een halfwaardetijd in bloed van 3-4 min. Het wordt snel omgezet in de lever en nieren naar diverse fragmenten, die naast het volledige hormoon in het bloed aanwezig kunnen zijn. De halfwaardetijd van de actieve N-terminale fragmenten is vergelijkbaar met die van iPTH, in tegenstelling tot de halfwaardetijd van de inactieve C-terminale fragmenten: die bedraagt 3-4 h.
PTH wordt in bloed gemeten met immunochemische testen die nog niet goed gestandaardiseerd zijn. De door de meeste laboratoria gebruikte tweede-generatietesten – ook wel iPTH-testen genoemd – zijn niet specifiek voor alleen intact PTH, in tegenstelling tot wat de naam suggereert. Ook lange C-terminale fragmenten worden gemeten; dit geeft een vertekend beeld van de daadwerkelijke concentratie actief PTH. Er bestaan ook derde-generatietesten, ‘bio-actief-PTH’ genoemd, die volledig specifiek zijn voor iPTH, maar de meerwaarde van deze testen is nog onduidelijk.2-3 Voor de diagnostiek van hypo- en hyperparathyreoïdie kunnen zowel de iPTH- als de bio-actief-PTH-testen gebruikt worden. Echter, voor de diagnostiek en het vervolgen van renale botziekte zijn tot nu toe altijd de iPTH-testen gebruikt en er bestaat vooralsnog geen voordeel voor de bio-actief-PTH-testen in deze setting.
PTH is slechts enkele uren stabiel in volbloed op kamertemperatuur. Afname op ijs is echter niet direct noodzakelijk. De stabiliteit verbetert naar 4-8 h door gebruik te maken van EDTA-ontstold bloed. Door dit verschil in stabiliteit zijn de referentiewaarden van PTH in serum en in EDTA-plasma duidelijk verschillend van elkaar.
Vitamine D Voor het in kaart brengen van de vitamine D-status is 25-hydroxyvitamine D de aangewezen bepaling. Analyse van plasma of serum gebeurt meestal met immunochemische of chromatografische technieken. De chromatografische technieken worden gezien als mogelijke referentiemethoden, waarbij de vloeistofchromatografie in combinatie met zogenaamde ‘tandem-massaspectrometrische detectie’ (LC-MS-MS-methode) de boventoon voert. Standaardisatie van analysemethoden wordt steeds beter; de huidige immunochemische methoden komen goed overeen met de chromatografische methoden. Er kunnen echter verschillen optreden bij patiëntenmonsters waarin zich 25-hydroxyvitamine D2 bevindt (dit is in kleine hoeveelheden afkomstig van plantaardige producten, en van vitaminesupplementen welke vaak hun oorsprong in het buitenland vinden). Deze component wordt niet door alle methoden in vergelijkbare mate gemeten. Een analysemethode die alleen 25-hydroxyvitamine D3 kan meten voldoet voor de huidige situatie in Nederland.
De prevalentie van vitamine D-insufficiëntie (gedefiniëerd als 25-hydroxyvitamine D-waarden < 50 nmol/l) is hoog: bij de totale bevolking ongeveer 40%.4 Hypocalciëmie komt echter alleen voor bij ernstig vitamine D-tekort (< 20 nmol/l). De meeste laboratoria rapporteren streefwaarden (> 50 nmol/l) als referentiewaarden.4 Streefwaarden zijn gebaseerd op een functionele relatie van 25-hydroxyvitamine D met onder andere PTH (bijvoorbeeld bij secundaire hyperparathyreoïdie door vitamine D-insufficiëntie); spierkracht (spierzwakte bij vitamine D-insufficiëntie) en botdichtheid (hoger risico op osteoporotische fracturen bij vitamine D-insufficiëntie). Het rapporteren van seizoensafhankelijke referentiewaarden is niet juist.
De meting van 1,25-dihydroxyvitamine D is slechts incidenteel relevant, bijvoorbeeld bij vitamine D-resistente rachitis ontstaan door chronische nierinsufficiëntie, bij 1-hydroxylase-deficiëntie, bij een defect van het renale fosfaattransport (type 1: verlaagd 1,25-dihydroxyvitamine D) en bij receptordefecten (type 2: verhoogd 1,25-dihydroxyvitamine D). Daarnaast is de bepaling van 1,25-dihydroxyvitamine D ook geïndiceerd bij hypoparathyreoïdie (waarbij de waarde verlaagd is) en wanneer er bij patiënten met een granulomateuze aandoening – zoals tuberculose en sarcoïdose – sprake is van hypercalciëmie.
Magnesium Magnesium is nodig voor de productie en werking van PTH. De totale concentratie magnesium wordt bepaald in serum of plasma. Ongeveer 50% is ongebonden en dit ionogeen magnesium kan met ionselectieve elektroden worden gemeten. De literatuur is echter niet eenduidig over eventuele voordelen ten opzichte van bepaling van de totale concentratie magnesium.5 Deze techniek is niet standaard in elk laboratorium beschikbaar.
24-uursexcretie van calcium in urine Om te bepalen of een afwijking in de calciumhomeostase aan problemen in de nieren ligt, kan de 24-uursexcretie van calcium in de urine bepaald worden. De 24-uursurine dient aangezuurd te worden alvorens analyse van calcium plaats kan vinden. Hiermee wordt neerslag van calciumzouten voorkomen. Indien dit niet gebeurt kan er een foutief verlaagde uitslag ontstaan.
Differentiële diagnostiek van hypercalciëmie
Hypercalciëmie kan verschillende oorzaken hebben; het palet van laboratoriumbepalingen en de uitslagen daarvan kunnen richting geven aan de diagnostiek van de onderliggende oorzaak (zie ook tabel 2). Enkele oorzaken worden hier toegelicht.
Hyperparathyreoïdie De prevalentie van primaire hyperparathyreoïdie is ongeveer 1:1000. Deze ziekte kan zich zowel bij mannen als vrouwen op alle leeftijden manifesteren, maar komt het meeste voor bij postmenopauzale vrouwen. Het onderliggende pathologische proces is meestal een adenoom, diffuse hyperplasie of in zeldzame gevallen een carcinoom van de bijschildklieren. Adenomen kunnen meervoudig aanwezig zijn en komen soms familiair voor als onderdeel van een multipele endocriene neoplasie (MEN). Daarnaast kan er een autonome PTH-secretie ontstaan door langdurige hypocalciëmische stimulatie bij patiënten met eindstadium nierfalen (zogenaamde tertiaire hyperparathyreoïdie). Hierbij is ondanks de verhoogde tubulaire reabsorptie van calcium, de netto calciumuitscheiding in de 24-uursurine ongestoord of zelfs verhoogd, mogelijk als gevolg van een toegenomen aanbod van calcium in het glomerulaire filtraat. De verhoogde uitscheiding van calcium stimuleert verdere PTH-secretie en dit verhoogt weer de extracellulaire calciumconcentratie.
Maligniteit Hypercalciëmie op basis van een maligniteit kan het gevolg zijn van lokale osteolyse bij botmetastases. Er is meestal geen relatie tussen de uitgebreidheid van botmetastasering en de ernst van hypercalciëmie. In afwezigheid van botmetastases kan de oorzaak van hypercalciëmie vaak verklaard worden door de secretie van humorale mediatoren (bijvoorbeeld PTH-gerelateerd peptide) of de extrarenale productie van 1,25-dihydroxyvitamine D door de tumor. Dit laatstgenoemde verschijnsel kan ook optreden bij chronisch granulomateuze ziekten zoals sarcoïdose, tuberculose en wegenergranulomatose.
Familiaire hypercalciëmie Familiaire hypocalciurische hypercalciëmie (FHH) is een zeldzame aandoening die ontstaat door een autosomaal dominante, inactiverende mutatie in de calciumgevoelige receptor van de bijschildklieren en de nieren. De ziekte is meestal al op kinderleeftijd aanwezig en asymptomatisch. Tevens bestaat er een verworven vorm waarbij auto-antilichamen tegen de calciumgevoelige receptor aanwezig zijn.
Overige, minder frequent voorkomende oorzaken van hypercalciëmie zijn: vitamine D-intoxicatie (concentratie 25-hydroxyvitamine D in serum of plasma >250 nmol/l); thyreotoxicose; het melk-alkalisyndroom (hypercalciëmie door overmatige inname van calciumrijke, alkalische stoffen zoals melk); behandeling met lithium of thiazidediuretica; en immobilisatie (waardoor verhoogde botafbraak ontstaat).
Differentiële diagnostiek van hypocalciëmie
Hypocalciëmie wordt vaak gezien bij patiënten met acute pancreatitis en met eindstadium nierfalen, maar is zelden symptomatisch. Er zijn vele verschillende oorzaken voor hypocalciëmie; deze kunnen vaak afgeleid worden van de uitslagen van verschillende laboratoriumbepalingen (zie ook tabel 3) en worden hier toegelicht.
Hypoparathyreoïdie kan aangeboren of verworven zijn. De laatstgenoemde vorm kan ontstaan door chirurgie (bijvoorbeeld na een thyreoïdectomie), een auto-immuunziekte of andere endocriene ziekten, hemochromatose, of door andere infiltratieve ziekten. Pseudohypoparathyreoïdie lijkt wat betreft symptomen op hypoparathyreoïdie, echter de plasmaconcentratie PTH is verhoogd. Dit verschil wordt veroorzaakt doordat bij pseudohypoparathyreoïdie sprake is van perifere resistentie tegen PTH en niet zozeer van een verminderde productie. Er bestaan 2 typen pseudohypoparathyreoïdie, die beide familiair zijn. Ook een magnesiumdeficiëntie kan leiden tot hypoparathyreoïdie of pseudohypoparathyreoïdie, aangezien magnesium vereist is voor zowel PTH-secretie als PTH-werking.
Bij hypocalciëmie moet ook gedacht worden aan mutaties in de calciumgevoelige receptor. Het gaat bij hypocalciëmie dan om activerende mutaties, in tegenstelling tot bij FHH. Wederom is de overerving autosomaal dominant en is het ziektebeeld veelal asymptomatisch.
Vitamine D-deficiëntie is meestal het gevolg van onvoldoende blootstelling aan zonlicht. Inadequate voeding en malabsorptie spelen een secundaire rol. Vitamine D-tekort leidt tot secundaire hyperparathyreoïdie waardoor hypofosfatemie kan ontstaan. Zoals eerder vermeld komt hypocalciëmie alleen voor bij ernstig vitamine D-tekort (< 20 nmol/l).
Andere oorzaken van hypocalciëmie zijn behandeling met anti-epileptica en massale transfusie met citraatbloed.
Referentiewaarden en beslisgrenzen
Doordat laboratoria gebruik maken van verschillende testmethoden, dient men rekening te houden met een verschil in testuitslagen. Dit geldt in het bijzonder voor uitslagen van de verschillende PTH-bepalingen, vanwege een matige standaardisatie. Het is dus belangrijk altijd de resultaten te vergelijken met de referentiewaarden die door het eigen laboratorium zijn vastgesteld. In tabel 4 staan de referentiewaarden zoals die door VieCuri Medisch Centrum gebruikt worden. Voor totaal calcium en anorganisch fosfaat gelden leeftijds- of geslachtsafhankelijke referentiewaarden. De hogere concentraties calcium en anorganisch fosfaat bij kinderen kunnen verklaard worden door botgroei. De concentratie anorganisch fosfaat bij vrouwen > 60 jaar is hoger dan bij mannen in dezelfde leeftijdscategorie. Dit ontstaat door botontkalking onder invloed van veranderingen in oestrogeenconcentraties bij postmenopauzale vrouwen.

Kosten
De tarieven van de meest aangevraagde parameters in het kader van calciummetabolisme, vastgesteld door het College Tarieven Gezondheidszorg (CTG), staan in tabel 5.

Wanneer is een laboratoriumparameter klinisch significant verschillend van de vorige uitslag?
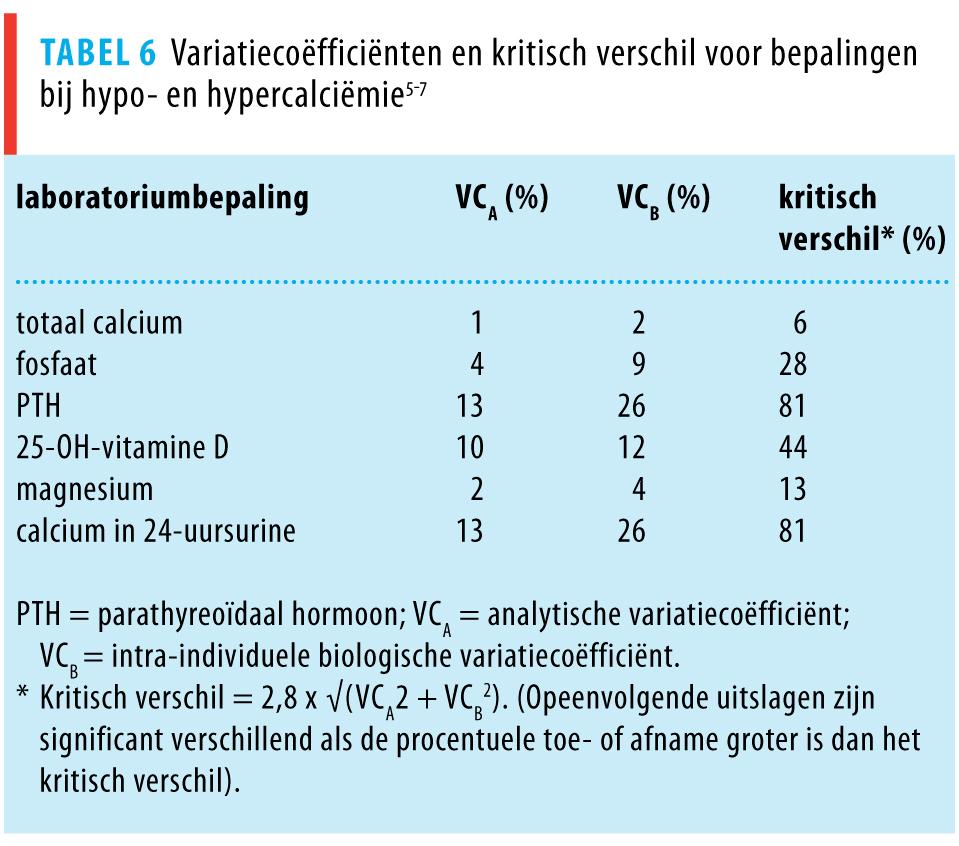
Als bij een patiënt een specifieke laboratoriumparameter herhaaldelijk bepaald wordt, is het belangrijk om te weten wanneer de waarden voldoende van elkaar verschillen om een behandeleffect aan te tonen. Dit kan met het ‘kritisch verschil’. Hierbij wordt met een betrouwbaarheid van 95% en op basis van de biologische en analytische variatie van elke test aangegeven of de waarden genoeg van elkaar verschillen.6 Voor de verschillende laboratoriumparameters bij calciumhuishouding staan de waarden van het kritisch verschil vermeld in tabel 6 (bron: http//www.westgard.com/biodatabase1.htm).7,8 Opeenvolgende uitslagen van laboratoriumparameters zijn significant verschillend van elkaar als de procentuele toe- of afname groter is dan het kritisch verschil voor die parameter.
Valkuilen
Men dient rekening te houden met een verschil in resultaten bij gebruik van verschillende methoden. Dit geldt in het bijzonder voor de verschillende bepalingen van PTH, vanwege matige standaardisatie. Het is dus belangrijk de resultaten altijd te vergelijken met de referentiewaarden die door het eigen laboratorium zijn vastgesteld. De concentratie totaal calcium kan foutief verhoogd zijn door een gestuwde bloedafname (pseudohypercalciëmie) en foutief verlaagd zijn door het gebruik van een onjuiste bloedbuis. De 24-uursexcretie van calcium in de urine kan foutief verlaagd zijn als de urine niet is aangezuurd voordat analyse plaatsvindt.
Uitleg 1
Classificatie van Marsh en Oberhuber Histologische bevindingen bij coeliakie worden ingedeeld volgens de classificatie van Marsh en Oberhuber. De indeling gebeurt op basis van het aantal intra-epitheliale lymfocyten, de villi en de crypten. Marsh 3C houdt in ‘plat-destructief’: > 30 intra-epitheliale lymfocyten per 100 enterocyten, totale villusatrofie en crypt-hyperplasie.1
Uitleg 2
Berekening van de gecorrigeerde calciumconcentratie in serum of plasma Bij een afwijkende waarde van albumine kan een vertekend beeld ontstaan van de calciumconcentratie. Er wordt geadviseerd de calciumconcentratie hiervoor te corrigeren. Dit kan met een berekening van de concentratie albumine ([albumine], in g/l) en de concentratie totaal calcium ([calcium], in mmol/l).
Indien [albumine] < 40: gecorrigeerde calciumconcentratie = [calcium] + 0,02 x (40 - [albumine])
Indien [albumine] > 45: gecorrigeerde calciumconcentratie = [calcium] - 0,02 x ([albumine] - 45)





Reacties